名校
1 . I.在恒温2L密闭容器中通入气体X并发生放热反应:2X(g) Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)______ 。
(2)图中c点对应的速率关系是v(正)______ v(逆)(填“>”或“<”或“=”);b曲线与a比改变的条件是______ 。
(3)反应进行到a点时放出的热量______ 反应进行到b点时放出的热量(填“>”或“<”或“=”)。
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。______ (计算保留2位有效数字)。
(5)能说明上述反应达到平衡状态的是______ (填字母)。
(6)平衡时CH3OH的体积分数为______ 。平衡混合气体中CO2(g)和H2(g)的质量之比是______ 。
(7)第3分钟时v正(CH3OH)______ 第9分钟时v逆(CH3OH)(填“>”“<”“=”或“无法比较”)。
III.在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。______ 。
(9)a、b、c、d四个点中,表示化学反应处于平衡状态的点是______ 。
 Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
Y(g),X的物质的量n(x)随时间t变化的曲线如图所示(图中两曲线分别代表有无使用催化剂的情形)
| A.升高温度 | B.加入适量X |
| C.增大压强 | D.及时分离出Y |
(2)图中c点对应的速率关系是v(正)
(3)反应进行到a点时放出的热量
II.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(5)能说明上述反应达到平衡状态的是
| A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点) |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内生成1molH2,同时生成1molCH3OH |
| D.混合气体的平均相对分子质量不随时间的变化而变化 |
(6)平衡时CH3OH的体积分数为
(7)第3分钟时v正(CH3OH)
III.在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。

(9)a、b、c、d四个点中,表示化学反应处于平衡状态的点是
您最近一年使用:0次
解题方法
2 . 工业合成氨的反应如下: 。某温度下,在容积恒定为2.0L的密闭容器中充入
。某温度下,在容积恒定为2.0L的密闭容器中充入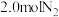 和
和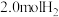 ,一段时间后反应达平衡状态,实验数据如下表所示:
,一段时间后反应达平衡状态,实验数据如下表所示:
(1)0~50s内的平均反应速率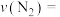
___________ 。
(2)150s时, 的转化率为
的转化率为___________ 。
(3)反应达最大限度时 的体积分数为
的体积分数为___________ %(保留三位有效数字)。
(4)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成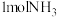 过程中的热量变化
过程中的热量变化___________ 。
(5)为加快反应速率,可以采取的措施___________ 。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离 f.使用适合催化剂
f.使用适合催化剂
(6)下列说法错误的是___________。
 。某温度下,在容积恒定为2.0L的密闭容器中充入
。某温度下,在容积恒定为2.0L的密闭容器中充入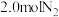 和
和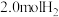 ,一段时间后反应达平衡状态,实验数据如下表所示:
,一段时间后反应达平衡状态,实验数据如下表所示:| t/s | 0 | 50 | 150 | 250 | 350 |
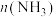 | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率
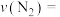
(2)150s时,
 的转化率为
的转化率为(3)反应达最大限度时
 的体积分数为
的体积分数为(4)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成
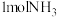 过程中的热量变化
过程中的热量变化(5)为加快反应速率,可以采取的措施
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离
 f.使用适合催化剂
f.使用适合催化剂(6)下列说法错误的是___________。
| A.使用催化剂是为了加快反应速率,提高生产效率 |
B.上述条件下, 不可能100%转化为 不可能100%转化为 |
C.为了提高 的转化率,应适当提高 的转化率,应适当提高 的浓度 的浓度 |
| D.250~350s生成物浓度保持不变,反应停止 |
您最近一年使用:0次
解题方法
3 . 在一密闭容器中进行反应: ,已知反应过程中某一时刻
,已知反应过程中某一时刻 、
、 、
、 的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是
的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是
 ,已知反应过程中某一时刻
,已知反应过程中某一时刻 、
、 、
、 的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是
的浓度分别为0.1mol/L、0.05mol/L、0.3mol/L。当反应达到平衡时,可能存在的数据是A. 为0.2mol/L, 为0.2mol/L, 为0.15mol/L 为0.15mol/L | B. 、 、 均为0.35mol/L 均为0.35mol/L |
C. 为0.4mol/L 为0.4mol/L | D. 为0.35mol/L 为0.35mol/L |
您最近一年使用:0次
名校
4 . 工业制氢,反应Ⅰ:
 ,
,
反应Ⅱ:
 。
。
维持T℃、560kPa不变,向容积可变的密闭容器中投入10mol 和10mol
和10mol  ,
, 、CO的转化率随时间的变化分别对应如图甲、乙曲线。下列说法错误的是
、CO的转化率随时间的变化分别对应如图甲、乙曲线。下列说法错误的是

 ,
,反应Ⅱ:

 。
。维持T℃、560kPa不变,向容积可变的密闭容器中投入10mol
 和10mol
和10mol  ,
, 、CO的转化率随时间的变化分别对应如图甲、乙曲线。下列说法错误的是
、CO的转化率随时间的变化分别对应如图甲、乙曲线。下列说法错误的是
A.开始时, 的分压 的分压 |
B.50min后反应到达平衡,平均反应速率可表达为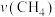 为2.24kPa/min 为2.24kPa/min |
C.保持温度不变,若增大压强, 的转化率变化曲线将是丙 的转化率变化曲线将是丙 |
| D.保持压强不变,若降低温度,CO的转化率变化曲线将是戊 |
您最近一年使用:0次
名校
解题方法
5 . 反应 ,经2min,B的浓度减少
,经2min,B的浓度减少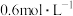 。对该反应速率的表示,下列说法正确的是
。对该反应速率的表示,下列说法正确的是
 ,经2min,B的浓度减少
,经2min,B的浓度减少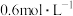 。对该反应速率的表示,下列说法正确的是
。对该反应速率的表示,下列说法正确的是A.用固体A表示的反应速率是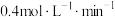 |
| B.用B、C、D表示的反应速率之比为3∶2∶1 |
C.在2min末,用B表示的反应速率是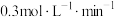 |
| D.用B、C表示该反应的反应速率大小不同,意义也不同 |
您最近一年使用:0次
名校
6 .  溶液和
溶液和 溶液可发生反应:
溶液可发生反应: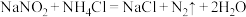 。为探究反应速率v与
。为探究反应速率v与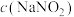 的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
 溶液、
溶液、 溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入
溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入 醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL
醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL 所需时间t。实验数据如下表。下列说法正确的
所需时间t。实验数据如下表。下列说法正确的
 溶液和
溶液和 溶液可发生反应:
溶液可发生反应: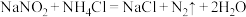 。为探究反应速率v与
。为探究反应速率v与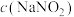 的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
的关系,进行如下实验:常温常压下,向锥形瓶中加入一定体积V的
 溶液、
溶液、 溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入
溶液和水,充分搅拌,无明显现象。控制体系温度,通过分液漏斗向锥形瓶中加入 醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL
醋酸。当导管口气泡均匀稳定冒出时,用排水法收集气体。用秒表测量收集1.0mL 所需时间t。实验数据如下表。下列说法正确的
所需时间t。实验数据如下表。下列说法正确的V/mL | t/s | ||||
|
| 醋酸 | 水 | ||
1 | 4.0 |
| 4.0 | 8.0 | 334 |
2 |
| 4.0 | 4.0 |
| 150 |
3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
A.实验3中,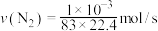 |
B.若实验4反应从开始到结束历时bs,则整个过程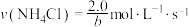 |
C. ;若 ;若 ,则 ,则 |
| D.醋酸可能作该反应的催化剂,且不改变反应历程 |
您最近一年使用:0次
名校
解题方法
7 . 研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
 .回答下列问题。
.回答下列问题。
(1)汽车在行驶过程中有如下反应发生:

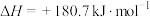

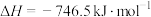
写出表示CO燃烧热的热化学方程式为___________ 。
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(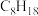 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为___________ (保留三位有效数字)。若实际空燃比大于此值,则该汽车尾气的主要污染物为___________ 。
(3)在汽车上安装三元催化转化器可实现反应:
 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
该反应在1~4s内的平均反应速率为
___________ 。反应达平衡时压强为100kPa,求压强平衡常数
___________  。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出): 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
(4)研究表明,合成氨的速率与相关物质的浓度关系为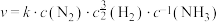 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。
(5)实际工业生产中,原料气中 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)___________ 。
(6)在氨气催化氧化制硝酸过程中,发现 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
① (快)
(快) 
② (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是___________ 。
 .回答下列问题。
.回答下列问题。(1)汽车在行驶过程中有如下反应发生:

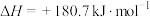

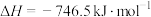
写出表示CO燃烧热的热化学方程式为
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(
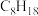 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为(3)在汽车上安装三元催化转化器可实现反应:

 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
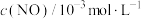 | 1.50 | 1.15 | 0.75 | 0.62 | 0.55 | 0.50 | 0.50 |
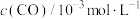 | 3.00 | 2.65 | 2.25 | 2.12 | 2.05 | 2.00 | 2.00 |


 。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)  .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):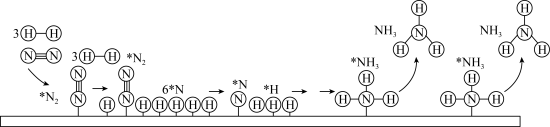
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。(4)研究表明,合成氨的速率与相关物质的浓度关系为
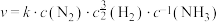 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。| A.合成氨的反应在任意温度下都能自发进行 |
B.增大 、 、 或 或 的浓度都能提高合成氨速率 的浓度都能提高合成氨速率 |
| C.若反应气中混有水蒸气,Fe催化剂可能中毒 |
| D.使用催化剂可提高单位时间内原料气的转化率 |
 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)(6)在氨气催化氧化制硝酸过程中,发现
 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:①
 (快)
(快) 
②
 (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是
您最近一年使用:0次
解题方法
8 . 近年,甲醇的制取与应用在全球引发了关于“甲醇经济”的广泛探讨。
 .在
.在 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:
反应a:

反应b:
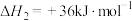
反应c: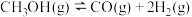

(1)已知反应b中相关化学键键能数据如下表:
计算:x=___________  ,
,
___________  。
。
(2)恒温恒容时,下列能说明反应a一定达到平衡状态的是___________(填标号)。
(3)在催化剂作用下,将物质的量之比为1:2的 和
和 的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率
的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率 ,
,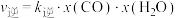 ,
, 、
、 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。
①平衡时, 转化率为60%,
转化率为60%, 和
和 的物质的量之比为1:1,若反应b的
的物质的量之比为1:1,若反应b的 ,则平衡
,则平衡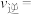
___________  。
。
②Arrhenius经验公式为 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
___________  (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。
(4)其他条件相同时,反应温度对 选择性的影响如下图所示。由图可知,温度相同时
选择性的影响如下图所示。由图可知,温度相同时 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是___________ 。(已知 的选择性
的选择性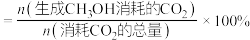 )
) .利用甲醇分解制取烯烃,涉及如下反应:
.利用甲醇分解制取烯烃,涉及如下反应:
a.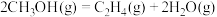
b.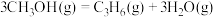
c.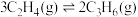
(5)恒压条件下,平衡体系中各物质的量分数随温度变化如图所示。已知650K时, ,平衡体系总压强为p,则650K反应c的平衡常数
,平衡体系总压强为p,则650K反应c的平衡常数
___________ 。
 .在
.在 催化加氢制
催化加氢制 的反应体系中,发生的主要反应如下:
的反应体系中,发生的主要反应如下:反应a:


反应b:

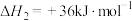
反应c:
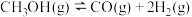

(1)已知反应b中相关化学键键能数据如下表:
| 化学键 | H-H | C=O | C≡O | H-O |
 | x | 803 | 1076 | 465 |
 ,
,
 。
。(2)恒温恒容时,下列能说明反应a一定达到平衡状态的是___________(填标号)。
A. |
B.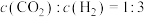 |
| C.混合气体的密度不再发生变化 |
D.混合气体中 的百分含量保持不变 的百分含量保持不变 |
 和
和 的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率
的混合气体充入一恒容密闭容器中发生反应a、b,已知反应b的反应速率 ,
,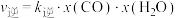 ,
, 、
、 为速率常数,x为物质的量分数。
为速率常数,x为物质的量分数。①平衡时,
 转化率为60%,
转化率为60%, 和
和 的物质的量之比为1:1,若反应b的
的物质的量之比为1:1,若反应b的 ,则平衡
,则平衡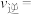
 。
。②Arrhenius经验公式为
 ,其中
,其中 为活化能,T为热力学温度,k为速率常数,R和C为常数,则
为活化能,T为热力学温度,k为速率常数,R和C为常数,则
 (用含
(用含 、
、 、T、R的代数式表示)。
、T、R的代数式表示)。(4)其他条件相同时,反应温度对
 选择性的影响如下图所示。由图可知,温度相同时
选择性的影响如下图所示。由图可知,温度相同时 选择性的实验值略高于其平衡值,可能的原因是
选择性的实验值略高于其平衡值,可能的原因是 的选择性
的选择性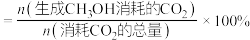 )
)
 .利用甲醇分解制取烯烃,涉及如下反应:
.利用甲醇分解制取烯烃,涉及如下反应:a.
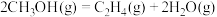
b.
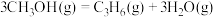
c.
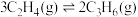
(5)恒压条件下,平衡体系中各物质的量分数随温度变化如图所示。已知650K时,
 ,平衡体系总压强为p,则650K反应c的平衡常数
,平衡体系总压强为p,则650K反应c的平衡常数
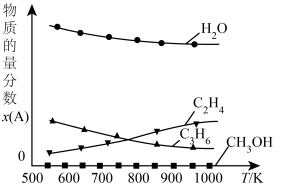
您最近一年使用:0次
9 . 某小组利用不同膜反应器(可选择性地让某些气体通过而离开体系)研究HI的分解率,工作原理如图所示。图a、b和c反应区温度维持恒定且相等,仅发生反应 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数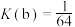 。
。
下列说法正确的是
 且在反应区内进行。投料均为1mol的
且在反应区内进行。投料均为1mol的 ,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数
,反应同时开始,80s时图b反应区处于瞬时平衡状态,其化学平衡常数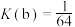 。
。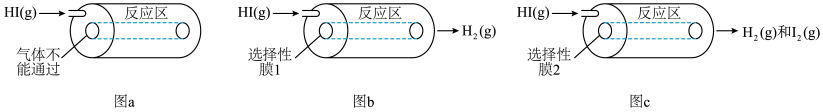
| 图a装置 | 图b装置 | 图c装置 | |
80s时反应区 的物质的量/mol 的物质的量/mol | 0.10 | 0.30 | x |
A.图a装置的化学平衡常数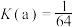 |
B.图a装置中,80s时 分解率为10% 分解率为10% |
| C.图c装置中,x一定大于0.3 |
D.图b装置中,前80s内 的平均渗透速率约为 的平均渗透速率约为 mol·s mol·s |
您最近一年使用:0次
名校
10 . 过硫酸钠(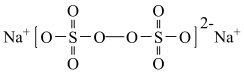 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
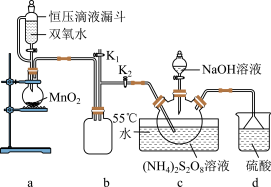
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。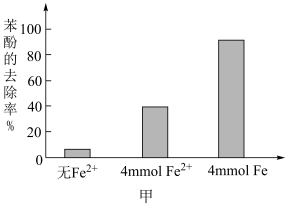
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
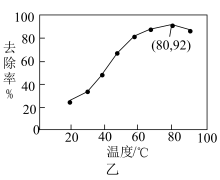
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为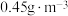 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: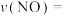
 。
。
您最近一年使用:0次






