名校
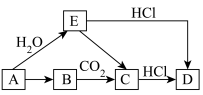
1 . Ⅰ.有如图所示各步变化(部分产物未写出),A为金属单质,B为淡黄色固体,物质A~E均含有钠元素。___________ ,D.___________ 。
(2)写出A→E的化学方程式并用双线桥标出电子转移的方向和数目:___________ 。
Ⅱ.完成下列问题
(3)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。亚铁离子极不稳定,二价铁易被空气或Cl2___________ (填“氧化”或“还原”)成三价铁,请写出亚铁离子与Cl2反应的离子方程式:___________ 。
(4)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。___________ 。
②该实验可证明NaHCO3的热稳定性___________ (填“强于”“弱于”或“等于”)Na2CO3;___________ (填“能”或“不能”)将NaHCO3、Na2CO3的位置互换。
(2)写出A→E的化学方程式并用双线桥标出电子转移的方向和数目:
Ⅱ.完成下列问题
(3)+2价的亚铁离子是血红蛋白(用于运输氧气)的重要组成成分。亚铁离子极不稳定,二价铁易被空气或Cl2
(4)某实验小组用“套管实验”来探究Na2CO3和NaHCO3的性质。
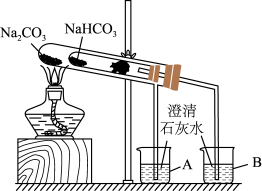
②该实验可证明NaHCO3的热稳定性
您最近一年使用:0次
名校
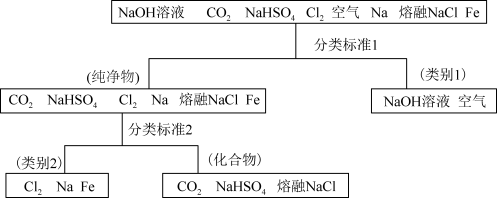
2 . 图所示为利用分类法对一组物质进行的分类。回答下列问题  属于
属于___________  填“酸性”或“碱性”
填“酸性”或“碱性” 氧化物,书写
氧化物,书写 与
与 反应的化学方程式
反应的化学方程式___________ ,依据该反应,可以说明
___________  填“属于”或“不属于”
填“属于”或“不属于” 碱性氧化物。
碱性氧化物。
(2)上述物质中属于电解质的是___________ 。
(3)某学生完成钠与水反应的实验,实验过程如图 、
、 、
、 所示,下列有关实验现象及结论的叙述
所示,下列有关实验现象及结论的叙述不正确 的是___________。 填序号
填序号
(4)工业上常用 与
与 溶液反应制取消毒液,该反应的化学方程式为
溶液反应制取消毒液,该反应的化学方程式为___________ 。
(5)向 溶液中加入NaOH溶液,对应的离子方程式为
溶液中加入NaOH溶液,对应的离子方程式为___________ 。
 属于
属于 填“酸性”或“碱性”
填“酸性”或“碱性” 氧化物,书写
氧化物,书写 与
与 反应的化学方程式
反应的化学方程式
 填“属于”或“不属于”
填“属于”或“不属于” 碱性氧化物。
碱性氧化物。(2)上述物质中属于电解质的是
(3)某学生完成钠与水反应的实验,实验过程如图
 、
、 、
、 所示,下列有关实验现象及结论的叙述
所示,下列有关实验现象及结论的叙述 填序号
填序号
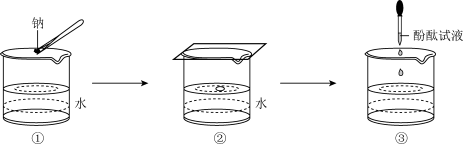
A.图 中钠熔成小球,说明钠与水反应放热且钠的熔点低 中钠熔成小球,说明钠与水反应放热且钠的熔点低 |
B.图 中钠四处游动并嘶嘶作响,说明反应产生了气体 中钠四处游动并嘶嘶作响,说明反应产生了气体 |
C.图 中滴加酚酞试液后溶液变红,说明有碱性物质生成 中滴加酚酞试液后溶液变红,说明有碱性物质生成 |
D.钠与水反应的离子方程式是: 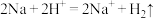 |
(4)工业上常用
 与
与 溶液反应制取消毒液,该反应的化学方程式为
溶液反应制取消毒液,该反应的化学方程式为(5)向
 溶液中加入NaOH溶液,对应的离子方程式为
溶液中加入NaOH溶液,对应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
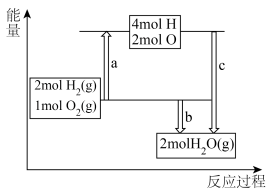
(1)已知破坏1 mol H-H、1 mol O=O、1 mol H-O时分别需要吸收436 kJ、498 kJ、465kJ的能量。H2、O2转化为H2O(g)反应过程的能量变化如图,则b表示的能量为________ 。_______________________________ 。
②电池工作一段时间后电解质溶液的pH___________ (填“增大”“减小”或“不变”)。
(3)CO2可通过反应 转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。___________ 。
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.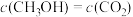
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率________ (填“>”“<”或“=”)逆反应速率。
③0 min~9 min 内,v(H2)=________ mol/(L·min)。
④平衡时CO2的转化率为________ 。
(1)已知破坏1 mol H-H、1 mol O=O、1 mol H-O时分别需要吸收436 kJ、498 kJ、465kJ的能量。H2、O2转化为H2O(g)反应过程的能量变化如图,则b表示的能量为
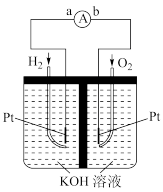
②电池工作一段时间后电解质溶液的pH
(3)CO2可通过反应
 转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
转化成有机物,实现碳循环。一定条件下,在体积为2L的恒容密闭容器中,充入2mol CO2(g)和6mol H2(g),测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。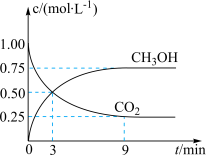
a.气体密度不再改变
b.混合气体的平均相对分子质量不再改变
c.
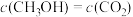
d.单位时间CO2和CH3OH(g)的消耗速率相等
②反应进行到3min时,正反应速率
③0 min~9 min 内,v(H2)=
④平衡时CO2的转化率为
您最近一年使用:0次
名校
4 . 氯气是现代工业和生活中常用的杀菌消毒剂。回答下列问题:
(1)实验室常用 固体和浓盐酸在加热条件下制取
固体和浓盐酸在加热条件下制取 ,反应的离子方程式为
,反应的离子方程式为___________ 。实验室还可用 固体和浓盐酸在室温条件下制取少量氯气(同时生成
固体和浓盐酸在室温条件下制取少量氯气(同时生成 和
和 ),可选用图中的
),可选用图中的___________ (选填“A”或“B”)作为发生装置,反应的离子方程式为___________ 。
(说明:试管中溶液均为 ,均滴入氯水5滴;淀粉遇
,均滴入氯水5滴;淀粉遇 变蓝)
变蓝)
①实验I中反应方程式为___________ ,由此推断氧化性:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
②实验Ⅱ中溶液变红是由于溶液中含有___________ (填微粒符号,下同);使溶液褪色的微粒是___________ 。
(1)实验室常用
 固体和浓盐酸在加热条件下制取
固体和浓盐酸在加热条件下制取 ,反应的离子方程式为
,反应的离子方程式为 固体和浓盐酸在室温条件下制取少量氯气(同时生成
固体和浓盐酸在室温条件下制取少量氯气(同时生成 和
和 ),可选用图中的
),可选用图中的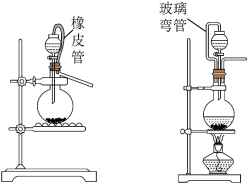
| 实验Ⅰ | 实验Ⅱ | |
| 实验操作 |
|
|
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |
 ,均滴入氯水5滴;淀粉遇
,均滴入氯水5滴;淀粉遇 变蓝)
变蓝)①实验I中反应方程式为

 (填“
(填“ ”或“
”或“ ”)。
”)。②实验Ⅱ中溶液变红是由于溶液中含有
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是2SO2+O2 2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。___________ 。
(2)图中a点,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(3)反应进行到第___________ 分钟时恰好达到平衡,结合图像分析,能说明SO2转化成SO3的反应在该条件下达到限度的证据是___________ 。
(4)下列说法错误的是___________。
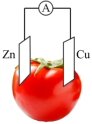
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
(5)该实验目的是研究水果种类和___________ 对水果电池电流大小的影响。
(6)该实验装置中,正极的材料是___________ ,负极的电极反应式是___________ 。
 2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
2SO3,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。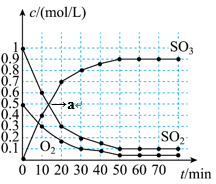
(2)图中a点,正反应速率
(3)反应进行到第
(4)下列说法错误的是___________。
| A.上述条件下,SO2不可能100%转化为SO3 |
| B.升高温度,可以实现SO2的完全转化 |
| C.通过调控反应条件,可以提高该反应进行的程度 |
| D.使用催化剂可以增大反应速率,提高生产效率 |
Ⅱ.以相同大小铜片和锌片为电极研究水果电池,得到的实验数据如下表所示:
| 实验编号 | 水果种类 | 电极间距离/cm | 电流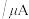 |
|
| 1 | 番茄 | 1 | 98.7 | |
| 2 | 番茄 | 2 | 72.5 | |
| 3 | 苹果 | 2 | 27.2 |
(6)该实验装置中,正极的材料是
您最近一年使用:0次
名校
6 . 能源的开发、利用与人类社会息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
(1)下列列举的能源中属于新能源的是_______ (填标号)。
a.煤炭 b.氢能 c.风能 d.地热能 e.太阳能 f.天然气
(2) 与
与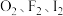 均能发生反应。
均能发生反应。
① 在
在 中燃烧生成水的过程中,能量转化的主要形式为
中燃烧生成水的过程中,能量转化的主要形式为_______ 转化为_______ 。
② 与
与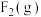 反应生成
反应生成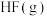 过程中的能量变化示意图如图1。
过程中的能量变化示意图如图1。 中的化学键需要
中的化学键需要_______ (填“吸收”或“放出”)的能量为_______  ;形成
;形成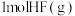 中的化学键需要
中的化学键需要_______ (填“吸收”或“放出”)的能量为_______  。
。
③ 与
与 反应生成
反应生成 过程中的能量变化示意图如图2。
过程中的能量变化示意图如图2。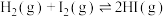 的正向反应为
的正向反应为_______ (填“吸热”或“放热”)反应;当反应 中有
中有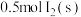 完全转化为
完全转化为 时,
时,_______ (填“吸收”或“放出”)的能量为_______  。
。
(1)下列列举的能源中属于新能源的是
a.煤炭 b.氢能 c.风能 d.地热能 e.太阳能 f.天然气
(2)
 与
与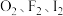 均能发生反应。
均能发生反应。①
 在
在 中燃烧生成水的过程中,能量转化的主要形式为
中燃烧生成水的过程中,能量转化的主要形式为②
 与
与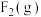 反应生成
反应生成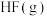 过程中的能量变化示意图如图1。
过程中的能量变化示意图如图1。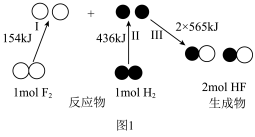
 中的化学键需要
中的化学键需要 ;形成
;形成 中的化学键需要
中的化学键需要 。
。③
 与
与 反应生成
反应生成 过程中的能量变化示意图如图2。
过程中的能量变化示意图如图2。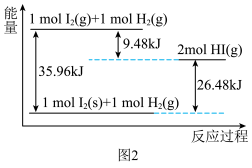
 的正向反应为
的正向反应为 中有
中有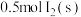 完全转化为
完全转化为 时,
时, 。
。
您最近一年使用:0次
7 . 硫的氧化物、氮的氧化物、硅的氧化物都是重要的化工原料。将其合理利用,既能减少污染,又能充分利用资源,创造价值。
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英的成分是_______ (填化学式),该物质的类别属于_______ 氧化物(填“碱性”、 “酸性”或“两性”),实验室中不能用带玻璃塞的试剂瓶盛放NaOH溶液,原因是_______________ (用离子方程式表示)。
(2)玻璃是常用的硅酸盐材料,生产普通玻璃的主要材料有________ 、_______ 、_______ ,工艺师常用_________ (填物质名称)来雕刻玻璃,其作用过程产生________ 气体。
(3)石英坩埚可以用来灼烧下面哪种物质_______。(填字母)
(4)SiO2在自然界中广泛存在,它是制备现代通讯材料_________ (写该材料名称)的主要原料
(5)在一定量的浓硫酸中加入过量铜片,加热使之反应,反应结束后。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为_________________ 。
(6)硝酸是一种重要的工业原料。在实验室中通常保存在棕色试剂瓶中,则原因是_______________ (用化学方程式表示)。硝酸是一种易挥发性的酸,用蘸浓硝酸和蘸浓氨水的玻璃棒靠近会产生大量白烟,白烟的成分是__________ 。
(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英的成分是
(2)玻璃是常用的硅酸盐材料,生产普通玻璃的主要材料有
(3)石英坩埚可以用来灼烧下面哪种物质_______。(填字母)
| A.碳酸钠 | B.氢氧化钠 | C.氢氧化钾 | D.氯化钠 |
(5)在一定量的浓硫酸中加入过量铜片,加热使之反应,反应结束后。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(6)硝酸是一种重要的工业原料。在实验室中通常保存在棕色试剂瓶中,则原因是
您最近一年使用:0次
名校
解题方法
8 . 酸碱中和滴定法在工农业生产和医药卫生等方面都有非常重要的作用。
I.某学生用0.2000mol·L 的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
(1)以上步骤有错误的是___________ (填编号)。
(2)判断滴定终点的现象:___________ 。
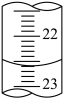
(3)如图是某次滴定时的滴定管中的液面,其读数为___________ mL。___________ mol⋅L-1。
II.温度t℃时,某NaOH稀溶液中 mol⋅L-1,
mol⋅L-1, mol⋅L-1,已知
mol⋅L-1,已知 ,请回答下列问题:
,请回答下列问题:
(5)该NaOH溶液中NaOH的物质的量浓度为___________ ,该NaOH溶液中由水电离出的 为
为___________ 。
(6)给该NaOH溶液加热时,pH___________ (填“变大”、“变小”或“不变”)。
I.某学生用0.2000mol·L
 的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
(1)以上步骤有错误的是
(2)判断滴定终点的现象:
(3)如图是某次滴定时的滴定管中的液面,其读数为
| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.402 | 0.40 |
| 第二次 | 20.00 | 2.002 | 4.10 |
| 第三次 | 20.00 | 4.002 | 4.00 |
II.温度t℃时,某NaOH稀溶液中
 mol⋅L-1,
mol⋅L-1, mol⋅L-1,已知
mol⋅L-1,已知 ,请回答下列问题:
,请回答下列问题:(5)该NaOH溶液中NaOH的物质的量浓度为
 为
为(6)给该NaOH溶液加热时,pH
您最近一年使用:0次
名校
9 . 硫酸是重要的化工原料,工业制硫酸的其中一步重要反应是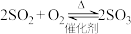 ,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。 的平均反应速率为
的平均反应速率为___________ 。
(2)图中a点,正反应速率___________ 逆反应速率(填“>”“<”或“=”)。
(3)反应进行到第___________ 分钟时恰好达到平衡,此时 的转化率为
的转化率为___________ 。
(4)下列说法正确的是___________。
(5)硫酸厂产生的尾气中含有少量 。双碱法脱硫的原理示意图如下:
。双碱法脱硫的原理示意图如下:___________ ,过程I的离子方程式为___________ 。
②理论上,过程 中消耗1mol氧气时,过程I中吸收
中消耗1mol氧气时,过程I中吸收 的体积(标准状况)是
的体积(标准状况)是___________ L。
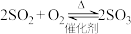 ,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
,正反应放热。一定条件下,恒容密闭容器中发生该反应,各物质浓度随时间变化的曲线如下图所示。
 的平均反应速率为
的平均反应速率为(2)图中a点,正反应速率
(3)反应进行到第
 的转化率为
的转化率为(4)下列说法正确的是___________。
A.反应过程中, 和 和 的转化率始终相等 的转化率始终相等 |
B.通过调控反应条件,可以实现 的完全转化 的完全转化 |
| C.其他条件不变,升高温度,正反应速率和逆反应速率均增大 |
| D.使用催化剂可以提高反应速率,提高生产效率 |
(5)硫酸厂产生的尾气中含有少量
 。双碱法脱硫的原理示意图如下:
。双碱法脱硫的原理示意图如下: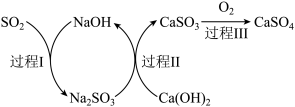
②理论上,过程
 中消耗1mol氧气时,过程I中吸收
中消耗1mol氧气时,过程I中吸收 的体积(标准状况)是
的体积(标准状况)是
您最近一年使用:0次
解题方法
10 . 某化合物W的分子结构可表示为
(2)W的一氯代物有
(3)下列有关W的说法错误的是___________;
| A.能发生氧化反应 | B.能发生加成反应 |
| C.能发生加聚反应 | D.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大 |
(4)写出W的芳香族同分异构体的结构简式
(5)下列选项中互为同系物的是
 和
和
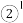 H、
H、 H、
H、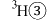


 与
与
 戊烯和环戊烷
戊烯和环戊烷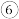

您最近一年使用:0次