2022高三·全国·专题练习
名校
解题方法
1 . 恒温恒容的密闭容器中,某催化剂表面发生氨的分解反应: ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
下列说法不正确的是
 ,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化
,测得不同起始浓度和催化剂表面积下氨的浓度随时间的变化| 编号 | 时间/min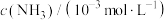 表面积/cm  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.实验①,0∼40min,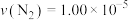 mol⋅L mol⋅L ∙min ∙min |
| B.相同条件下,增加氨气的浓度,反应速率增大 |
| C.相同条件下,增加催化剂的表面积,反应速率增大 |
D.实验②,60min时处于平衡状态, |
您最近一年使用:0次
2023-11-23更新
|
94次组卷
|
31卷引用:考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)
(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省双鸭山市第一中学2021-2022学年高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期期末考试化学试题(已下线)第16练 化学反应的速率与限度-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省浙里卷天下2022-2023学年高三8月开学测试化学试题江西省新余市第一中学2022-2023学年高二上学期开学考试化学试题辽宁省朝阳市建平县实验中学2022-2023学年高二上学期第一次月考化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题(已下线)易错点22 化学反应平衡和移动-备战2023年高考化学考试易错题天津市五校(杨村宝坻蓟州芦台静海一中)2022-2023学年高二上学期期中考试化学试题黑龙江省佳木斯市第一中学2022-2023学年高三上学期第三次调研化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷A(已下线)化学预测卷(五)-预测卷(浙江专版)安徽省合肥一六八中学2022-2023学年高二上学期化学学科学情调研试题辽宁省营口市2022-2023学年高三上学期期末考试化学试题上海市奉贤区2022-2023学年高三上学期一模练习卷化学试题北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题(已下线)专题09 化学反应速率与化学平衡(讲)-2023年高考化学二轮复习讲练测(新高考专用)安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题(已下线)第13练 化学反应速率与化学平衡的综合考查 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)第二章 章末训练(已下线)考点2 化学平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)河南省周口恒大中学2023-2024学年高二上学期11月期中考试化学试题吉林省长春市第二实验中学2023-2024学年高二上学期10月月考化学试题(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
名校
2 . 下列说法正确的是
A. 其他条件不变,增大反应容器体积,正逆反应速率不变 其他条件不变,增大反应容器体积,正逆反应速率不变 |
B. ,碳的质量不再改变说明反应已达平衡 ,碳的质量不再改变说明反应已达平衡 |
C.若平均相对分子质量不再随时间变化能说明反应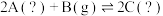 已达平衡,则A、C不能同时是气体 已达平衡,则A、C不能同时是气体 |
D.4mol 分解为 分解为 和 和 的转化率为10%时,吸收热量 的转化率为10%时,吸收热量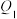 ;在相同温度和压强下,当2mol ;在相同温度和压强下,当2mol 和6mol 和6mol 反应达到平衡时 反应达到平衡时 转化率为10%,放出热量 转化率为10%,放出热量 , , 不等于 不等于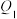 |
您最近一年使用:0次
2023-11-23更新
|
148次组卷
|
2卷引用:北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
3 . 完成下列问题
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式___________ ;H、B、N中,原子半径最大的是___________ 。
② 分子中
分子中___________ (填“存在”或“不存在”)配位键。
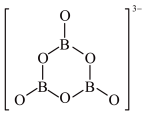
③氨硼烷在一定条件下和水发生如下反应: ,
, 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由___________ 变为___________ ;反应涉及的N、B、O三种元素的第一电离能从大到小的顺序为___________ 。
(2) 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
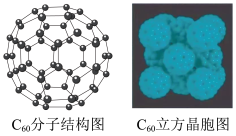
① 晶体属于
晶体属于___________ 晶体,每个 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为___________ 个;
②凸多面体中有欧拉定理:顶点+面-棱边=2,则 分子中的五边形数目为
分子中的五边形数目为___________ ,六边形的数目为___________ ;
(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为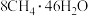 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面,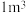 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下___________  甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式
②
 分子中
分子中③氨硼烷在一定条件下和水发生如下反应:
 ,
, 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由
(2)
 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
①
 晶体属于
晶体属于 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为②凸多面体中有欧拉定理:顶点+面-棱边=2,则
 分子中的五边形数目为
分子中的五边形数目为(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为
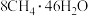 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面,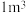 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下 甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
您最近一年使用:0次
名校
解题方法
4 . Ti和P的化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)Ti的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,四种卤化物熔点变化的原因是
熔点依次升高,四种卤化物熔点变化的原因是___________ 。(已知:电负性:Ti 1.5;F 4.0;Cl 3.0;Br 2.8;I 2.5)
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器等的功能材料。
①基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
② 的晶胞如图甲所示,金属离子与氧离子间的作用力为
的晶胞如图甲所示,金属离子与氧离子间的作用力为___________ 。 的配位数是
的配位数是___________ 。 、
、 和有机碱离子
和有机碱离子 ,晶胞如图乙所示(与甲晶胞取法不同)。其中
,晶胞如图乙所示(与甲晶胞取法不同)。其中 与图甲中
与图甲中___________ 的空间位置相同。 的立体结构为
的立体结构为___________ 。
②磷酸通过分子间脱水缩合形成多磷酸,如:___________ 。
(1)Ti的四卤化物熔点如下表所示,
 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,四种卤化物熔点变化的原因是
熔点依次升高,四种卤化物熔点变化的原因是| 化合物 |  |  |  |  |
| 熔点/℃ | 377 | 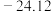 | 38.3 | 155 |
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器等的功能材料。
①基态
 原子的核外电子排布式为
原子的核外电子排布式为②
 的晶胞如图甲所示,金属离子与氧离子间的作用力为
的晶胞如图甲所示,金属离子与氧离子间的作用力为 的配位数是
的配位数是
 、
、 和有机碱离子
和有机碱离子 ,晶胞如图乙所示(与甲晶胞取法不同)。其中
,晶胞如图乙所示(与甲晶胞取法不同)。其中 与图甲中
与图甲中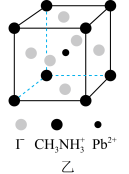
 的立体结构为
的立体结构为②磷酸通过分子间脱水缩合形成多磷酸,如:
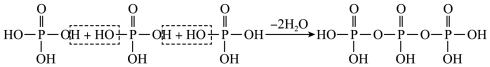
您最近一年使用:0次
名校
5 . 小组同学探究盐溶液对反应 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与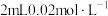 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
ii. (黄色)
(黄色)
iii.已知 对实验无影响
对实验无影响
下列说法不正确的是
 (血红色)的影响。将
(血红色)的影响。将
 的
的 溶液与
溶液与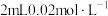 的
的 溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。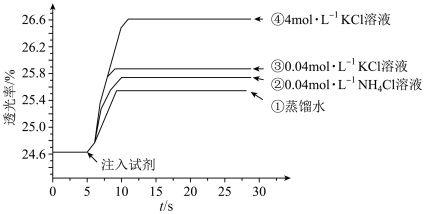
ii.
 (黄色)
(黄色)iii.已知
 对实验无影响
对实验无影响下列说法不正确的是
A.注入试剂①后溶液透光率增大,证明 逆向移动 逆向移动 |
B.透光率③比②高,可能是阳离子种类或溶液 不同导致的 不同导致的 |
C.透光率④比③高,可能发生了反应 |
D.若要证明试剂③中 对平衡体系有影响,还应使用 对平衡体系有影响,还应使用 的 的 溶液进行对照实验 溶液进行对照实验 |
您最近一年使用:0次
2023-11-21更新
|
366次组卷
|
7卷引用:北京市对外经济贸易大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
6 . 室温下,下列有关叙述正确的是
①分别向等体积、等物质的量浓度的盐酸和醋酸中滴加NaOH溶液,使溶液呈中性,醋酸消耗的NaOH多;
②等体积、等pH的盐酸和醋酸,分别与NaOH反应,使溶液成恰好中和,醋酸消耗的NaOH多;
③相同条件下,将pH=2的硫酸溶液和pH=2的醋酸溶液分别稀释成pH=5的溶液,所加水的体积前者大;
④pH=3的稀硫酸跟pH=11的氢氧化钠溶液等体积混合,混合溶液的pH<7;
⑤相同条件下,将同体积pH=2的硫酸溶液和pH=2的醋酸溶液分别与锌粒反应后者生成氢气体积比前者大;
⑥同体积同浓度的盐酸和醋酸与足量锌反应,整个反应过程的平均反应速率盐酸的快。
①分别向等体积、等物质的量浓度的盐酸和醋酸中滴加NaOH溶液,使溶液呈中性,醋酸消耗的NaOH多;
②等体积、等pH的盐酸和醋酸,分别与NaOH反应,使溶液成恰好中和,醋酸消耗的NaOH多;
③相同条件下,将pH=2的硫酸溶液和pH=2的醋酸溶液分别稀释成pH=5的溶液,所加水的体积前者大;
④pH=3的稀硫酸跟pH=11的氢氧化钠溶液等体积混合,混合溶液的pH<7;
⑤相同条件下,将同体积pH=2的硫酸溶液和pH=2的醋酸溶液分别与锌粒反应后者生成氢气体积比前者大;
⑥同体积同浓度的盐酸和醋酸与足量锌反应,整个反应过程的平均反应速率盐酸的快。
| A.①②⑤ | B.③④⑤ | C.②④⑤ | D.②⑤⑥ |
您最近一年使用:0次
2023-11-17更新
|
199次组卷
|
2卷引用:云南省临沧市第一中学2022-2023学年高二上学期期中考试化学试题
7 . 碘番酸可用于X射线的口服造影液,其合成路线如图所示。
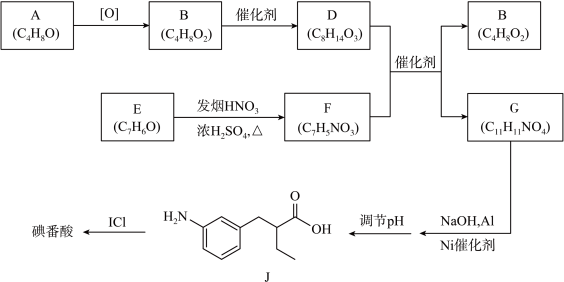
已知:R-COOH+R′-COOH
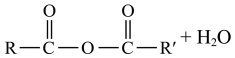
(1)A可以发生银镜反应,B无支链,B的结构简式为___________ ;B的一种同分异构体中只有一种化学环境氢,其结构简式为___________ 。
(2)E是芳香族化合物,E→F的方程式为___________ 。
(3)G中有乙基,则G的结构简式为___________ 。
(4)碘番酸中的碘在苯环不相邻的碳原子上,碘番酸的相对分子质量为571,J的相对分子质量为193。则碘番酸的结构简式为___________ 。
(5)通过滴定法来确定口服造影液中碘番酸的质量分数。
第一步取amg样品,加入过量Zn粉、NaOH溶液后加热,将I元素全部转为 ,冷却,洗涤。
,冷却,洗涤。
第二步调节溶液pH,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为cmL,已知口服造影液中无其它含碘物质,则碘番酸的质量分数为
溶液的体积为cmL,已知口服造影液中无其它含碘物质,则碘番酸的质量分数为___________ 。

已知:R-COOH+R′-COOH

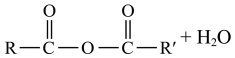
(1)A可以发生银镜反应,B无支链,B的结构简式为
(2)E是芳香族化合物,E→F的方程式为
(3)G中有乙基,则G的结构简式为
(4)碘番酸中的碘在苯环不相邻的碳原子上,碘番酸的相对分子质量为571,J的相对分子质量为193。则碘番酸的结构简式为
(5)通过滴定法来确定口服造影液中碘番酸的质量分数。
第一步取amg样品,加入过量Zn粉、NaOH溶液后加热,将I元素全部转为
 ,冷却,洗涤。
,冷却,洗涤。第二步调节溶液pH,用

 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为cmL,已知口服造影液中无其它含碘物质,则碘番酸的质量分数为
溶液的体积为cmL,已知口服造影液中无其它含碘物质,则碘番酸的质量分数为
您最近一年使用:0次
名校
解题方法
8 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为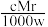 | B.物质的量浓度c可表示为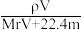 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为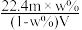 |
您最近一年使用:0次
2023-10-29更新
|
1168次组卷
|
42卷引用:湖北省荆州中学2021-2022学年高一上学期期末考试化学试题
湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
9 .  催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: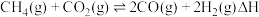 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(
 ):
):
则 催化重整反应的
催化重整反应的
_______  。
。
(2)将原料按初始组成
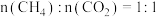 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为
 发生反应。达到平衡时,
发生反应。达到平衡时,
 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
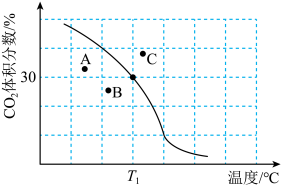
①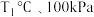 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=_______ 。该温度下,此反应的平衡常数
_______  (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
②若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_______ 点对应的平衡常数最小,理由是_______ 。
(3)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后,
 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则
_______  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的
_______ z点对应的 。
。
(4) 和
和
 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
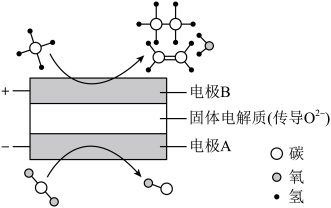
①阴极的电极反应式为_______ 。
②若生成的乙烯和乙烷的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: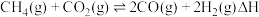 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(
 ):
):| 物质 |  |  |  |
燃烧热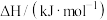 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)将原料按初始组成
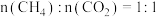 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
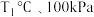 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=
 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。②若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则(3)其他条件相同,在不同催化剂(A、B)作用下,反应
 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用
 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的

 。
。(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极的电极反应式为
②若生成的乙烯和乙烷的体积比为
 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
2023-10-29更新
|
681次组卷
|
4卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
解题方法
10 . 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知在25℃和101kPa时存在下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H1=-3116kJ•mol-1
②C(石墨,s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ•mol-1
写出表示乙烷标准摩尔生成焓的热化学方程式_______ 。(标准摩尔生成焓是指在25℃和101kPa时,由元素最稳定的单质生成1mol纯化合物的焓变。)
(2)在一容积为2L的密闭容器中,CO和H2的初始物质的量均为0.3mol,在一定条件下发生反应:2CO(g)+2H2(g) CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
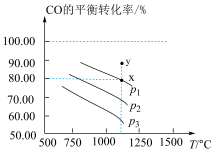
①由图可知,压强p3______ (填“>”或“<”)p1;压强为p2时,升高温度,反应的平衡常数将______ (填“增大”、“减小”或“不变”)。
②温度为1100℃、压强为p1时,x、y点:v正(x)______ (填“>”或“<”)v正(y);x点的平衡常数Kx为______ (Kx是指用平衡时各组分的物质的量百分数代替物质的量浓度计算得到的平衡常数)。
③在一定温度、p=160kPa的初始条件下,该反应达到平衡后体系的压强变为100kPa,则CO的平衡转化率为______ 。
④下列说法能说明该反应在上述条件下达到平衡状态的是______ (填字母)。
A.体系的密度不再发生变化
B.断裂2molH-H键的同时断裂2molC=O键
C.各组分的物质的量浓度不再改变
D.体系的气体的平均相对分子质量不再发生变化
E.体积分数:V%(CH4)=V%(CO2)
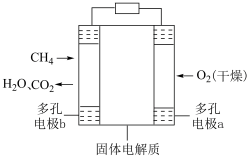
(3)固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,则b区发生的电极反应式为________ 。
(1)已知在25℃和101kPa时存在下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H1=-3116kJ•mol-1
②C(石墨,s)+O2(g)=CO2(g) △H2=-393.5kJ•mol-1
③2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ•mol-1
写出表示乙烷标准摩尔生成焓的热化学方程式
(2)在一容积为2L的密闭容器中,CO和H2的初始物质的量均为0.3mol,在一定条件下发生反应:2CO(g)+2H2(g)
 CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
CH4(g)+CO2(g) △H,测得CO的平衡转化率与温度、压强关系如图所示:
①由图可知,压强p3
②温度为1100℃、压强为p1时,x、y点:v正(x)
③在一定温度、p=160kPa的初始条件下,该反应达到平衡后体系的压强变为100kPa,则CO的平衡转化率为
④下列说法能说明该反应在上述条件下达到平衡状态的是
A.体系的密度不再发生变化
B.断裂2molH-H键的同时断裂2molC=O键
C.各组分的物质的量浓度不再改变
D.体系的气体的平均相对分子质量不再发生变化
E.体积分数:V%(CH4)=V%(CO2)
(3)固体氧化物甲烷燃料电池以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,则b区发生的电极反应式为

您最近一年使用:0次



