名校
1 . 三价砷毒性很强,其废水需要处理后才能排放。
Ⅰ.常温下,用 溶液滴定
溶液滴定 时,①~④四种含砷微粒的物质的量分数随
时,①~④四种含砷微粒的物质的量分数随 的变化曲线如图所示,其中
的变化曲线如图所示,其中 、
、 、
、 、
、 四点的横坐标分别为
四点的横坐标分别为 、
、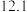 、
、 和
和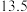 。
。 的
的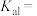
_____ 。
(2)结合化学用语解释 溶液显碱性的原因
溶液显碱性的原因_____ 。
(3)下列说法正确的是_____ 。(填字母)
A. 点的溶液中,
点的溶液中,
B. 在12~14之间,随
在12~14之间,随 增大,
增大,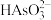 电离程度增大,
电离程度增大, 减小
减小
C.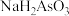 溶液中,
溶液中,
Ⅱ.用化学沉降法处理酸性含砷废水的工艺流程如下: 与过量的
与过量的 存在反应:
存在反应: ;
; 
(4)用平衡移动原理解释加入 的作用是
的作用是_____ 。
(5)写出 与含砷物质反应的化学方程式
与含砷物质反应的化学方程式_____ 。
(6)沉淀 为
为_____ 。
(7)含砷废水允许排放标准为 。若低浓度含砷废水(假设砷均以
。若低浓度含砷废水(假设砷均以 形式存在)中
形式存在)中 的浓度为
的浓度为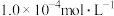 ,定量说明该含砷废水是否符合排放标准
,定量说明该含砷废水是否符合排放标准_____ 。
Ⅰ.常温下,用
 溶液滴定
溶液滴定 时,①~④四种含砷微粒的物质的量分数随
时,①~④四种含砷微粒的物质的量分数随 的变化曲线如图所示,其中
的变化曲线如图所示,其中 、
、 、
、 、
、 四点的横坐标分别为
四点的横坐标分别为 、
、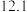 、
、 和
和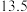 。
。
 的
的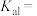
(2)结合化学用语解释
 溶液显碱性的原因
溶液显碱性的原因(3)下列说法正确的是
A.
 点的溶液中,
点的溶液中,
B.
 在12~14之间,随
在12~14之间,随 增大,
增大,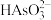 电离程度增大,
电离程度增大, 减小
减小C.
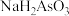 溶液中,
溶液中,
Ⅱ.用化学沉降法处理酸性含砷废水的工艺流程如下:

 与过量的
与过量的 存在反应:
存在反应: ;
; 
(4)用平衡移动原理解释加入
 的作用是
的作用是(5)写出
 与含砷物质反应的化学方程式
与含砷物质反应的化学方程式(6)沉淀
 为
为(7)含砷废水允许排放标准为
 。若低浓度含砷废水(假设砷均以
。若低浓度含砷废水(假设砷均以 形式存在)中
形式存在)中 的浓度为
的浓度为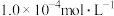 ,定量说明该含砷废水是否符合排放标准
,定量说明该含砷废水是否符合排放标准
您最近一年使用:0次
2024-01-21更新
|
152次组卷
|
3卷引用:北京市丰台区2023-2024学年高二上学期期末考试化学试题
名校
解题方法
2 . 回答下列问题:
(1)已知PH3与NH3结构相似,PH3的电子式___________ ,键角PH3___________ NH3(填“大于”“小于”“等于”,下同),热稳定性:PH3___________ NH3。
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的___________ 区(填分区)。
②基态Ni3+核外电子排布式为___________ 。
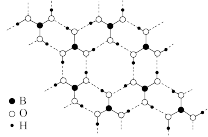
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为___________ (填元素符号),
②图中各微粒间不存在的作用力有___________ (填标号)。
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为___________ 。
(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH) 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式___________ 。
(1)已知PH3与NH3结构相似,PH3的电子式
(2)Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用。
①Fe元素位于元素周期表的
②基态Ni3+核外电子排布式为
(3)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如下图所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为
②图中各微粒间不存在的作用力有
a. 配位键 b.极性键 c.非极性键 d.π键 e.离子键 f.氢键
(4)如图为H3BO3晶体的片层结构,其中B的杂化方式为

(5)硼酸(H3BO3)为一元弱酸,电离方程式H3BO3+H2O⇌H++B(OH)
 。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
。已知:H3BO3的电离常数Ka=5.8×10﹣10,H2CO3的电离常数Ka1=4.4×10﹣7、Ka2=4.7×10﹣11,向饱和硼酸溶液中滴加少量Na2CO3溶液,写出发生反应的离子方程式
您最近一年使用:0次
3 . 已知25℃时部分弱电解质的电离平衡常数如表所示,回答下列有关问题:
(1) 第一步的电离方程式是
第一步的电离方程式是___________ ,浓度均为0.5mol/L的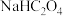 、
、 、HCN溶液中,pH最大的是
、HCN溶液中,pH最大的是___________ (填溶质的化学式)。
(2)常温下,体积均为10mL、pH=2的醋酸溶液与硫酸溶液分别加蒸馏水稀释a倍和b倍到pH=4,a___________ b(填“大于”“小于”或“等于”)。
(3)25℃时,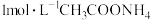 溶液显
溶液显___________ 性(填“酸”“中”或“碱”)性。
(4)将氯化铝溶液加热蒸干并灼烧得到的固体为___________ , 是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的
是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的 ,实际工业上将
,实际工业上将 与
与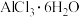 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是___________ 。
(5)相同条件下,0.1mol/L下列溶液中,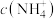 由小到大的排列顺序是
由小到大的排列顺序是___________ (填序号)。
A. B.
B. C.
C. D.
D.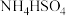 E.
E.
(6)甲酸钠(HCOONa)溶液呈碱性的原因是___________ (用离子方程式表示)。0.02mol/L的HCOONa溶液中
___________ mol/L。
| 化学式 |  |  | HCN |  |
| 电离平衡常数 | 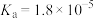 | 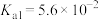 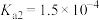 | 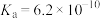 | 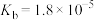 |
 第一步的电离方程式是
第一步的电离方程式是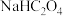 、
、 、HCN溶液中,pH最大的是
、HCN溶液中,pH最大的是(2)常温下,体积均为10mL、pH=2的醋酸溶液与硫酸溶液分别加蒸馏水稀释a倍和b倍到pH=4,a
(3)25℃时,
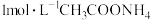 溶液显
溶液显(4)将氯化铝溶液加热蒸干并灼烧得到的固体为
 是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的
是一种液态化合物,遇水剧烈反应,有白雾和能使品红溶液褪色的刺激性气味的 ,实际工业上将
,实际工业上将 与
与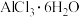 混合共热,可得到无水
混合共热,可得到无水 ,其原因是
,其原因是(5)相同条件下,0.1mol/L下列溶液中,
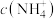 由小到大的排列顺序是
由小到大的排列顺序是A.
 B.
B. C.
C. D.
D.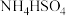 E.
E.
(6)甲酸钠(HCOONa)溶液呈碱性的原因是

您最近一年使用:0次
2024-01-09更新
|
60次组卷
|
2卷引用:宁夏银川二中2023-2024学年高二上学期月考二化学试题
名校
4 .  是一种二元弱酸,
是一种二元弱酸, 时其电离平衡常数
时其电离平衡常数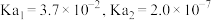 。
。
(1)① 溶液与足量
溶液与足量 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
② 时,向
时,向 的
的 溶液中滴加等浓度等体积的
溶液中滴加等浓度等体积的 溶液(溶液体积变化忽略不计),则溶液中的
溶液(溶液体积变化忽略不计),则溶液中的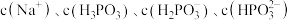 微粒浓度从大到小的排列顺序为
微粒浓度从大到小的排列顺序为___________ 。
(2)某温度下,四种酸在冰醋酸中的电离常数如下表:
下列说法正确的是___________。
(3)液氨与水一样可以发生微弱电离,如: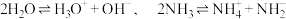
①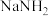 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②醋酸和氢氟酸在水溶液中为弱酸,但在液氨中都显强酸性的原因可能是___________ 。
 是一种二元弱酸,
是一种二元弱酸, 时其电离平衡常数
时其电离平衡常数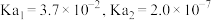 。
。(1)①
 溶液与足量
溶液与足量 溶液反应的离子方程式为
溶液反应的离子方程式为②
 时,向
时,向 的
的 溶液中滴加等浓度等体积的
溶液中滴加等浓度等体积的 溶液(溶液体积变化忽略不计),则溶液中的
溶液(溶液体积变化忽略不计),则溶液中的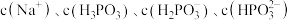 微粒浓度从大到小的排列顺序为
微粒浓度从大到小的排列顺序为(2)某温度下,四种酸在冰醋酸中的电离常数如下表:
| 酸 |  |  |  |  |
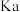 |  | 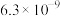 |  | 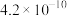 |
| A.用浓硫酸和氯化钠固体加热制氯化氢是因为在水中硫酸的酸性比盐酸的酸性强 |
B.冰醋酸中可以发生反应: |
C.冰醋酸中 的电离方程式为: 的电离方程式为: |
D.向硫酸的冰醋酸溶液中加入 ,硫酸的电离程度增大 ,硫酸的电离程度增大 |
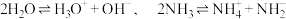
①
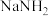 与
与 反应的化学方程式为
反应的化学方程式为②醋酸和氢氟酸在水溶液中为弱酸,但在液氨中都显强酸性的原因可能是
您最近一年使用:0次
2023-12-23更新
|
90次组卷
|
2卷引用:浙江省北斗星盟2023-2024学年高二上学期12月月考化学试题
名校
5 . 研究海洋中珊瑚礁(主要成分CaCO3)的形成机制及其影响具有重要意义,相关主要反应有:
反应Ⅰ:CO2(aq)+H2O(l)
 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7
反应Ⅱ: (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11
反应Ⅲ:CaCO3(s) Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9
请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是_______ (填“温暖海域”或“冰冷海域”),该反应的平衡常数K=_______ (用K1、K2、K3表示)。
(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势_______ 。_______ 0(填“>”“<”或“=”);随温度的升高,容器中CO2的浓度在T3温度下出现最低值的原因是_______ 。
反应Ⅰ:CO2(aq)+H2O(l)

 (aq)+H+(aq) K1=4.5×10-7
(aq)+H+(aq) K1=4.5×10-7反应Ⅱ:
 (aq)
(aq)
 (aq)+H+(aq) K2= 4.7×10-11
(aq)+H+(aq) K2= 4.7×10-11反应Ⅲ:CaCO3(s)
 Ca2+(aq)+
Ca2+(aq)+ (aq) K3=3.4×10-9
(aq) K3=3.4×10-9请回答:
(1)珊瑚礁形成的总反应可表示为Ca2+(aq)+2
 (aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是
(aq)=CaCO3(s)+CO2(aq)+H2O(l)。有利于珊瑚礁形成的环境是(2)海水的pH为8.0~8.3,下列有关珊瑚礁形成过程的叙述中正确的是_______。
A.海水中最主要的含碳微粒为 |
B.海水中的c(Ca2+)>c( )+c( )+c( ) ) |
C. 、 、 的水解反应是海水呈弱碱性的主要原因 的水解反应是海水呈弱碱性的主要原因 |
D.珊瑚礁形成的反应阻碍了 的电离 的电离 |
(3)温室气体CO2的浓度上升,会导致海水酸化,促使珊瑚礁的溶解。科学家模拟海洋环境探究不同温度下海水中CO2浓度与
 浓度间的关系。已知T1℃下测得c(CO2)与c(
浓度间的关系。已知T1℃下测得c(CO2)与c( )的关系如图,请画出T2℃(T2>T1)时c(
)的关系如图,请画出T2℃(T2>T1)时c( )随c(CO2)的变化趋势
)随c(CO2)的变化趋势

您最近一年使用:0次
名校
解题方法
6 . 金属钒在新能源动力电池中有重要作用。含钒尖晶石是钒渣中最主要的含钒物相,其主要成分有V2O3、FeO、Fe2O3、Al2O3、SiO2,采用以下工艺流程制备V2O5。 的形式存在。
的形式存在。
(1)“焙烧”过程中被氧化的元素是___________ 。
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是___________ 。
(3)“沉淀1”的成分是___________ 。
(4)“沉淀2”加热分解后固体产物的用途___________ (任写一种)。
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因_____ (结合平衡移动原理解释)。
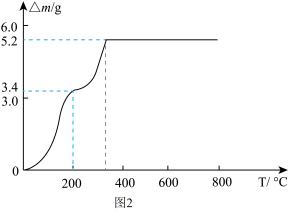
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是___________ 。___________ 。
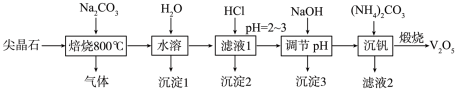
 的形式存在。
的形式存在。(1)“焙烧”过程中被氧化的元素是
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是
(3)“沉淀1”的成分是
(4)“沉淀2”加热分解后固体产物的用途
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是

您最近一年使用:0次
2023-11-27更新
|
192次组卷
|
2卷引用:宁夏银川市第二中学2023-2024学年高三上学期统练四 化学试题
名校
7 . Ⅰ.盐类水解知识。
(1)氯化铁水溶液呈___________ 性,原因是用离子方程式表示:___________ ;把 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是___________ ;普通泡沫灭火器是利用溶液跟溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是:_________ 。
Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(2)物质的量浓度均为0.1 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是___________ (用编号填写)
a. b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是________
A. B.
B. C.
C.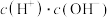
D. E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(5)25℃时,将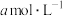 的醋酸与
的醋酸与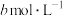 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___________ 。
(1)氯化铁水溶液呈
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 |  | 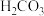 | HClO |
| 电离平衡常数 | 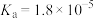 | 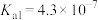 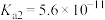 |  |
 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是a.
 b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1

 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A.
 B.
B. C.
C.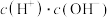
D.
 E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(5)25℃时,将
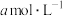 的醋酸与
的醋酸与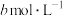 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
您最近一年使用:0次
2023-11-11更新
|
222次组卷
|
2卷引用:广西玉林市2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
8 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径、CO、捕获与CO2重整是CO2利用的研究热点,
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
则 △H=
△H=________ kJ∙mol−1。
(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
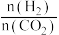 ]的变化如图所示:
]的变化如图所示:_____ T2(填“>”“<”或“=”),依据为________ ;
②图中a=________ ;
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为________ 。
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为___________ (写离子符号);若所得溶液

 溶液pH=
溶液pH=_____ (室温下,
 的
的
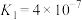 ;
;
 )。
)。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是___________ 。
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
| 共价键 | C=O | C-O | H-H | H-O | C-H |
| 键能/(kJ·mol⁻¹) | 799 | 343 | 436 | 463 | 413 |
 △H=
△H=(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
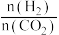 ]的变化如图所示:
]的变化如图所示:
②图中a=
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为

 溶液pH=
溶液pH= 的
的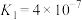 ;
; )。
)。(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是
您最近一年使用:0次
2023-10-29更新
|
376次组卷
|
2卷引用:内蒙古自治区赤峰市2024届高三上学期10月一轮复习大联考化学试题
解题方法
9 . 氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:___________ 。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaHN2O2)___________ pH(NaNO2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=___________ (保留三位有效数字)。
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为___________ 。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为___________ 。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=______ ,该反应的平衡常数K的值为_____ 。
②图2中能正确反应平衡常数K随温度变化关系的曲线为_____ (填字母标号)。
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=
②图2中能正确反应平衡常数K随温度变化关系的曲线为
您最近一年使用:0次
名校
10 . 氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用肼
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。
①已知各共价键键能如下表:
 的结构为
的结构为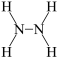 。
。
 ;
;
________  。
。
② 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因___________ 。
(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
① 的电离平衡常数的表达式
的电离平衡常数的表达式
___________ ;
②常温下,等浓度的下列溶液a. ;b.
;b. ;c.
;c. ,其
,其 由大到小的顺序是
由大到小的顺序是___________ (用字母表示)。
(3)某同学设计一个肼
 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
 为阳离子交换膜。
为阳离子交换膜。
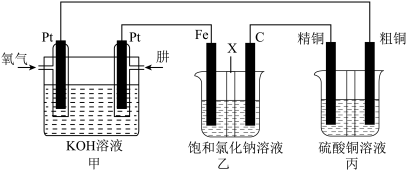
①通入肼的电极为___________ (填“正极”或“负极”),正极的电极反应式为___________ 。
②若甲中有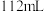 氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为___________ ,丙中硫酸铜溶液的浓度___________ (填“变大”、“变小”或“不变”)。
(1)航天领域中常用肼
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。①已知各共价键键能如下表:
 |  |  |  |  | |
键能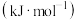 | 946 | 497 | 193 | 391 | 463 |
 的结构为
的结构为 。
。 ;
;
 。
。②
 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
| 弱电解质 |  |  |  |
电离平衡常数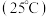 | 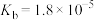 | 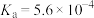 | 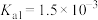 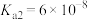 |
 的电离平衡常数的表达式
的电离平衡常数的表达式
②常温下,等浓度的下列溶液a.
 ;b.
;b. ;c.
;c. ,其
,其 由大到小的顺序是
由大到小的顺序是(3)某同学设计一个肼
 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中 为阳离子交换膜。
为阳离子交换膜。
①通入肼的电极为
②若甲中有
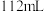 氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
您最近一年使用:0次



