名校
解题方法
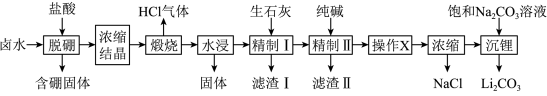
1 . 盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
已知:常温下, 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡: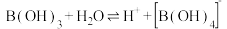 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,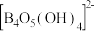 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为___________ ,该溶液pH=___________ 。
(2)滤渣Ⅰ的主要成分是___________ (填化学式);精制Ⅰ后溶液中Li+浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在___________  以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加___________ 的用量(填化学式)。
(3)精制Ⅱ的目的是___________ ;进行操作X时应选择的试剂是___________ 。
 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
已知:常温下,
 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。 
回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡:
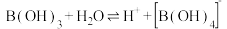 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,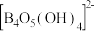 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为(2)滤渣Ⅰ的主要成分是
 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加(3)精制Ⅱ的目的是
您最近一年使用:0次
2024-03-14更新
|
593次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷
名校
解题方法
2 . Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:
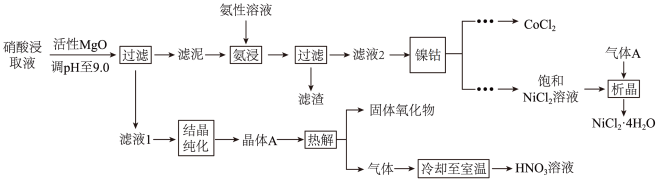
已知:氨性溶液由NH3·H2O、(NH4)2SO3和(NH4)2CO3配制。常温下,Ni2+、Co2+、Co3+与NH3形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;Co(OH)2易被空气氧化为Co(OH)3;部分氢氧化物的Ksp如下表。
回答下列问题:
(1)常温下,pH=9.9的氨性溶液中,c(NH3·H2O)_______ c( )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
(2)“氨浸”时,由Co(OH)3转化为[Co(NH3)6]2+的离子方程式为_______ ,“滤渣”的成分是_______ 。
(3)(NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。(NH4)2CO3提高了Ni、Co的浸取速率,其原因是_______ 。
(4)“析晶”过程中通入的酸性气体A为_______ 。
(5)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得HNO3溶液中n(HNO3)与n(H2O)的比值,理论上最高为_______ 。
②“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用_______ 和_______ (填化学式)。

已知:氨性溶液由NH3·H2O、(NH4)2SO3和(NH4)2CO3配制。常温下,Ni2+、Co2+、Co3+与NH3形成可溶于水的配离子:lgKb(NH3·H2O)=-4.7;Co(OH)2易被空气氧化为Co(OH)3;部分氢氧化物的Ksp如下表。
| 氢氧化物 | Co(OH)2 | Co(OH)3 | Ni(OH)2 | Al(OH)3 | Mg(OH)2 |
| Ksp | 5.9×10-15 | 1.6×10-44 | 5.5×10-16 | 1.3×10-33 | 5.6×10-12 |
(1)常温下,pH=9.9的氨性溶液中,c(NH3·H2O)
 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。(2)“氨浸”时,由Co(OH)3转化为[Co(NH3)6]2+的离子方程式为
(3)(NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。(NH4)2CO3提高了Ni、Co的浸取速率,其原因是
(4)“析晶”过程中通入的酸性气体A为
(5)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得HNO3溶液中n(HNO3)与n(H2O)的比值,理论上最高为
②“热解”对于从矿石提取Ni、Co工艺的意义,在于可重复利用
您最近一年使用:0次
3 . 已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:
回答下列问题:
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为___________ (填序号)。
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___________ 。
(3)将浓度为0.02mol·L-1的HCN与0.01 mol·L-1NaOH溶液等体积混合,则混合溶液中c(H+ )___________ c(OH- )(填“>”、“<”或 “=”)。
(4)常温下,向浓度为0.1mol·L-1、体积为V L的氨水中逐滴加入 一定浓度的盐酸,用pH计测溶液的pH,变化曲线如图所示,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
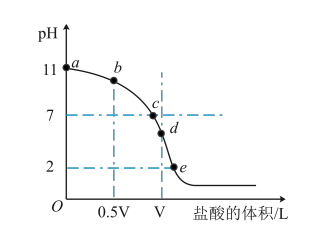
①该温度时NH3·H2O的电离常数Kb≈___________ ;
②b、c、d三点的溶液中,由水电离出的c(H+)由大到小的顺序为___________ ;
③根据以上滴定曲线判断点d所示溶液中:c(Cl-)= c(NH3·H2O)+___________ 。
| 化学式 | CH3COOH | H2CO3 | HCN |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)25℃时,pH相等的三种溶液①CH3COONa溶液、②Na2CO3溶液、③NaCN溶液,浓度由大到小的顺序为
(2)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为
(3)将浓度为0.02mol·L-1的HCN与0.01 mol·L-1NaOH溶液等体积混合,则混合溶液中c(H+ )
(4)常温下,向浓度为0.1mol·L-1、体积为V L的氨水中逐滴加入 一定浓度的盐酸,用pH计测溶液的pH,变化曲线如图所示,d点两种溶液恰好完全反应。根据图中信息回答下列问题:

①该温度时NH3·H2O的电离常数Kb≈
②b、c、d三点的溶液中,由水电离出的c(H+)由大到小的顺序为
③根据以上滴定曲线判断点d所示溶液中:c(Cl-)= c(NH3·H2O)+
您最近一年使用:0次
名校
解题方法
4 . 砷及其化合物有着广泛的用途,但也会严重危害环境安全和人体健康。
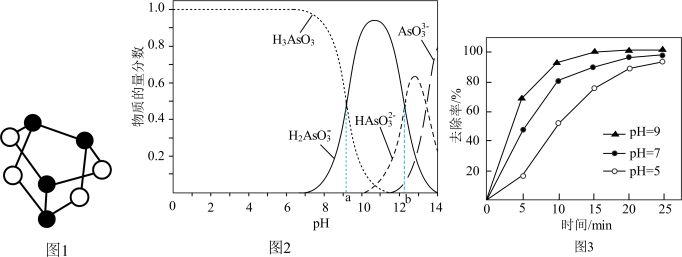
(1)雌黄(As2S3)和雄黄(As4S4)都是提取砷的主要矿物原料。砷元素有+2、+3、+5等常见价态。
①如图1为As4S4分子的空间结构模型。已知As2S3分子中没有π键,其结构式可表示为_____________ 。
②将含砷废渣(主要成分是As2S3)制成浆料再通入O2氧化,转化为H3AsO4和单质硫,是工业提取砷元素的途径之一,写出As2S3转化为H3AsO4的化学方程式____________ ;该反应需要在加压下进行,原因是____________ 。
(2)As2S3可转化为用于治疗白血病的亚砷酸(H3AsO3)。H3AsO3在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图2所示。
①H3AsO3的电离常数分别为Ka1=10-9.2、K a2=10-12.1、K a3=10-13.4,则b点pH=_______________ 。
②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图3所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是____________ 。
(3)水体中As(Ⅲ)的毒性远高于As(V)且As(Ⅴ)更易除去,常用的处理方法是先将废水中的As(Ⅲ)氧化为As(V),再通过一定方法除去As(V)。
①H3AsO3可被H2O2进一步氧化为H3AsO4。H3AsO3的酸性____________ H3AsO4的酸性(填“>”或“<”)。
②在pH=7的水溶液中,以足量的FeCl3为沉淀剂,可将HAsO4-转化为FeAsO4沉淀除去,其离子方程式为____________ 。【已知: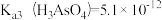 ,
,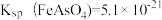 】
】
(4)油画创作通带需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:
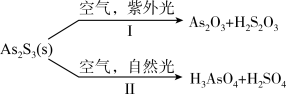
下列说法正确的是____________。

(1)雌黄(As2S3)和雄黄(As4S4)都是提取砷的主要矿物原料。砷元素有+2、+3、+5等常见价态。
①如图1为As4S4分子的空间结构模型。已知As2S3分子中没有π键,其结构式可表示为
②将含砷废渣(主要成分是As2S3)制成浆料再通入O2氧化,转化为H3AsO4和单质硫,是工业提取砷元素的途径之一,写出As2S3转化为H3AsO4的化学方程式
(2)As2S3可转化为用于治疗白血病的亚砷酸(H3AsO3)。H3AsO3在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图2所示。
①H3AsO3的电离常数分别为Ka1=10-9.2、K a2=10-12.1、K a3=10-13.4,则b点pH=
②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生Fe(OH)3胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图3所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是
(3)水体中As(Ⅲ)的毒性远高于As(V)且As(Ⅴ)更易除去,常用的处理方法是先将废水中的As(Ⅲ)氧化为As(V),再通过一定方法除去As(V)。
①H3AsO3可被H2O2进一步氧化为H3AsO4。H3AsO3的酸性
②在pH=7的水溶液中,以足量的FeCl3为沉淀剂,可将HAsO4-转化为FeAsO4沉淀除去,其离子方程式为
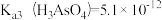 ,
,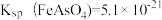 】
】(4)油画创作通带需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是____________。
A.S2O 和SO 和SO 的空间结构都是正四面体形 的空间结构都是正四面体形 |
| B.反应I和Ⅱ中,元素As和S都被氧化 |
| C.反应I和Ⅱ中,氧化1 mol As2S3转移的电子数之比为3:7 |
D.反应I和Ⅱ中,参加反应的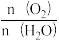 :I<Ⅱ :I<Ⅱ |
您最近一年使用:0次
5 . 高氯酸三碳酰肼合镍 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:
(1)基态Ni原子的电子排布式为_______ 。
(2)基态碳原子核外电子有_______ 种不同运动状态。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为_______ , 的VSEPR模型是
的VSEPR模型是_______ 。
(4)化学式中的CHZ为碳酰肼,其结构为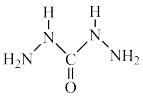 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:
①CHZ中氮原子的杂化轨道类型为_______ 。
②1molCHZ中含有的σ键数目为_______ NA。
③键角:
_______ (填“>”“<”或“=”) 。
。
(5)常温下, 的HClO溶液的pH约为
的HClO溶液的pH约为_______ [已知: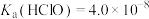 ,
, ]。
]。
 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:(1)基态Ni原子的电子排布式为
(2)基态碳原子核外电子有
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为 的VSEPR模型是
的VSEPR模型是(4)化学式中的CHZ为碳酰肼,其结构为
 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:①CHZ中氮原子的杂化轨道类型为
②1molCHZ中含有的σ键数目为
③键角:

 。
。(5)常温下,
 的HClO溶液的pH约为
的HClO溶液的pH约为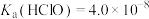 ,
, ]。
]。
您最近一年使用:0次
名校
解题方法
6 . “吃饺子要蘸醋”是很多中国人传统的饮食习惯,我们对醋酸的使用有着悠久的历史。
(1) 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
_______ (填“>”“<”或“=”)所得盐酸的 。
。
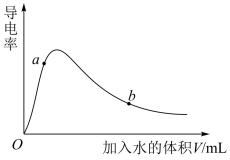
(2)取 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
①由水电离出的氢离子 :a
:a_______ b(填“>”“<”或“=”)。
②使图中b点对应的溶液中 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是_______ (填标号)。
A.加入 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体
(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ;判断 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为_______ 。
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石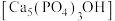 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:_______ [已知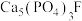 难溶于酸]。
难溶于酸]。
(5)常温下,某同学取 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为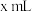 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
_______ (用含x的代数式表示)。

(1)
 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
 。
。(2)取
 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。①由水电离出的氢离子
 :a
:a②使图中b点对应的溶液中
 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是A.加入
 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知
 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式: 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为| 弱酸 |  |  |  |
| 电离平衡常数 | 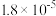 | 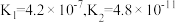 | 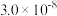 |
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石
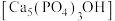 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因: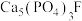 难溶于酸]。
难溶于酸]。(5)常温下,某同学取
 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为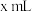 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
您最近一年使用:0次
2024-02-26更新
|
129次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期末考试化学试题
解题方法
7 . CuCl是见光容易分解的白色固体,难溶于水和乙醇,在潮湿的环境中易被氧化和水解。实验室制备CuCl的实验装置如下图所示,制取步骤如下:
①组装好整套实验装置,称取 的
的 晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
②在 左右向A装置中通入
左右向A装置中通入 气体,搅拌;
气体,搅拌;
③当A中溶液全部褪色,停止通 气体;
气体;
④实验结束后,先向A装置中加入适量蒸馏水,减压过滤(需避光),可得到CuCl粗产品;
⑤用乙醇洗涤CuCl粗产品,将产品在双层干燥器(分别装有浓硫酸和碱石灰)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品质量为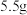 。
。
已知CuCl在溶液中存在如下平衡: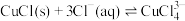 (aq,无色)。
(aq,无色)。
(1)基态S原子核外电子一共有________ 种不同的空间运动状态;液态 能发生自偶电离
能发生自偶电离 ,与
,与 互为等电子体的分子有
互为等电子体的分子有________ (写化学式,任写一种即可)。
(2)装置A的名称是________ ,多孔玻璃泡的作用是________________________ 。
(3)步骤②涉及的离子方程式为___________________________________ 。
(4)步骤④中,加入适量蒸馏水的目的是________________________________ 。
(5)步骤⑤用乙醇洗涤CuCl粗产品的原因是_______________________ 。
(6)本实验的产率是________ (保留3位有效数字)。
(7)假设在 下:
下:
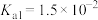 ,
, ,
, 且
且 ,测得反应后烧杯中的溶液
,测得反应后烧杯中的溶液 ,则烧杯中所发生的离子方程式为
,则烧杯中所发生的离子方程式为________________________ 。
①组装好整套实验装置,称取
 的
的 晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;
晶体,加适量煮沸后冷却的蒸馏水,使固体全部溶解,将其置于A装置中;②在
 左右向A装置中通入
左右向A装置中通入 气体,搅拌;
气体,搅拌;③当A中溶液全部褪色,停止通
 气体;
气体;④实验结束后,先向A装置中加入适量蒸馏水,减压过滤(需避光),可得到CuCl粗产品;
⑤用乙醇洗涤CuCl粗产品,将产品在双层干燥器(分别装有浓硫酸和碱石灰)中干燥34h,再经氢气流干燥,最后进行真空干燥,得到产品质量为
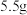 。
。已知CuCl在溶液中存在如下平衡:
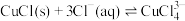 (aq,无色)。
(aq,无色)。
(1)基态S原子核外电子一共有
 能发生自偶电离
能发生自偶电离 ,与
,与 互为等电子体的分子有
互为等电子体的分子有(2)装置A的名称是
(3)步骤②涉及的离子方程式为
(4)步骤④中,加入适量蒸馏水的目的是
(5)步骤⑤用乙醇洗涤CuCl粗产品的原因是
(6)本实验的产率是
(7)假设在
 下:
下:
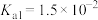 ,
, ,
, 且
且 ,测得反应后烧杯中的溶液
,测得反应后烧杯中的溶液 ,则烧杯中所发生的离子方程式为
,则烧杯中所发生的离子方程式为
您最近一年使用:0次
解题方法
8 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。回答下列问题:
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②
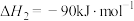
(1)若反应①为慢反应,请在图中接着完善画出反应②的能量变化曲线,标注出相应的物质(含聚集状态)以及总反应的 (含具体数值)
(含具体数值) _______ 。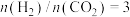 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为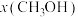 ,在
,在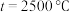 下的
下的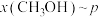 、在
、在 下的
下的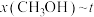 如图所示。
如图所示。_______ (填“a”或“b”),判断的理由_______ 。
(b)当 时,
时, 的平衡转化率
的平衡转化率
_______ 。
Ⅱ.催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。弱电解质的电离度是指弱电解质在溶液中达到电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的>的百分数,用a表示。而在实验测定中,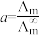 ,
,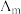 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,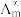 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,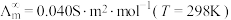 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的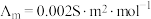 。
。
(3)在298K时,乙酸的电离平衡常数
_______ (列出计算式,不需化简)。
(4)在298K时,几种离子的摩尔电导率如下表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择,最适宜的电解质为_______ (填化学式)。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。总反应可表示为:


该反应一般认为通过如下步骤来实现:
①


②

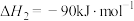
(1)若反应①为慢反应,请在图中接着完善画出反应②的能量变化曲线,标注出相应的物质(含聚集状态)以及总反应的
 (含具体数值)
(含具体数值) 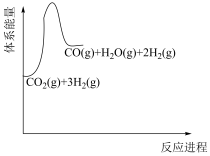
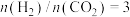 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为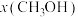 ,在
,在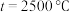 下的
下的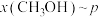 、在
、在 下的
下的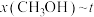 如图所示。
如图所示。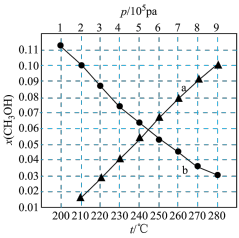
(b)当
 时,
时, 的平衡转化率
的平衡转化率
Ⅱ.催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。弱电解质的电离度是指弱电解质在溶液中达到电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的>的百分数,用a表示。而在实验测定中,
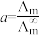 ,
,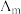 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,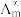 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,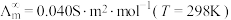 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的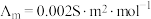 。
。(3)在298K时,乙酸的电离平衡常数

(4)在298K时,几种离子的摩尔电导率如下表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择,最适宜的电解质为
| 离子种类 |  |  |  |  |  |  |
摩尔电导率/( ) ) | 349.82 | 79.80 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
9 . 联氨(N2H4)又称“肼”,具高吸湿性、沸点386.5K、毒性强、还原性强等特性,燃烧释放出大量的热,常用于做火箭的燃料以及分析试剂中的还原剂。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式___________ ;此反应中,被氧化的元素是_____ 。每生成1mol肼,转移的电子数为________ 。
Ⅱ .联氨的结构
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是________ 。
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是_____ 。
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是_____ 。
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是_____ (填写化学式)。实验发现0.1mol·L-1N2H6SO4溶液显酸性,原因是_____ (用离子方程式表示),溶液中各种含氮微粒存在关系c(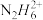 )+c(N2H6OH+)
)+c(N2H6OH+)____ 0.1-c(N2H4·2H2O)(选填“>”,“<”或“=”)。
(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是_______ 。肼有剧毒,但目前仍被普遍用作火箭的燃料,原因是________ 。
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
室温下,则同浓度的HNO2和HN3,其pH值:HNO2____ HN3(选填“>”、“<”或“=”),  反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为_________ 。
(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
并已知1molN2H4(l)→N2H4(g)与2molH2O2(l)→H2O2(g)共吸热23.76kJ,据此估算化学反应N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)的焓变ΔH=_______ kJ·mol-1,反应的熵变ΔS _____ 0(选填“>”、“<”)。研究小组利用此反应设计出如下电池,负极电极反应式:N2H4+4OH-−4e-=N2+4H2O。则正极电极反应式:________ 。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式
Ⅱ .联氨的结构
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是
|
|
| A. 反式结构 | B. 顺式结构 |
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是
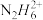 )+c(N2H6OH+)
)+c(N2H6OH+)(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
| 酸名 | 亚硝酸(HNO2) | 叠氮酸(HN3) |
| 电离平衡常数 | 5.1 x 10-4 | 1.8 x 10-5 |
 反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
| 化学键 | N-H | O-H | O-O | N-N | N≡N |
| 键能(kJ·mol-1) | 391 | 467 | 138 | 159 | 945 |
您最近一年使用:0次
名校
解题方法
10 . 铜矿石(主要成分3Cu2SAs2S3、Cu3AsS4)的熔炼过程排放的烟气含有As2O3、SO2等有害成分,水洗烟气形成污酸。工业上可以利用铁碳床处理污酸,将其中的S(Ⅳ)还原为H2S,进而生成难溶于水的As2S3,除去污酸中S、As及重金属元素。
(1)用化学用语表示烟气溶于水显酸性的原因___________ 。
(2)采用铁碳床而非纯铁床的原因是___________ 。
(3)配平下列方程式:__________
Fe+SO2+___________=H2S+___________+___________
(4)①铁碳床中铁碳比为1:1条件下处理污酸,As的去除率及质量浓度随反应时间变化如图所示。3h内,砷去除平均速率是___________ gL-1h-1。

②污酸经过铁碳床处理后,再加入Na2SO3或通入SO2继续除砷,As的去除率变化如下图所示。
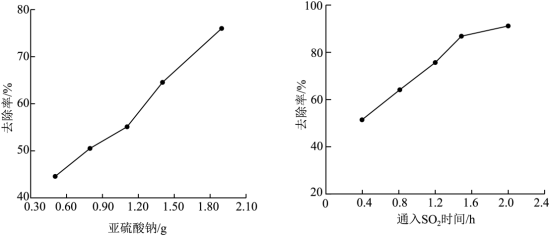
反应2h,砷去除率随Na2SO3质量的变化图通入0.64gSO2,砷去除率随反应时间的变化图甲同学认为,加入相同物质的量的Na2SO3和SO2,加入SO2时As的去除效率更好,相应的证据是___________ 。
(5)处理后污酸中砷的残留量的测定:取处理后的污酸100mL,将其中的As全部转化为 ,加入过量KI溶液和几滴淀粉溶液,用Pt电极进行电解,阳极附近溶液变蓝时,停止电解。电解过程中,阴极产生氢气,阳极产物与
,加入过量KI溶液和几滴淀粉溶液,用Pt电极进行电解,阳极附近溶液变蓝时,停止电解。电解过程中,阴极产生氢气,阳极产物与 反应,将其氧化为
反应,将其氧化为 ①电解时,阳极反应式为
①电解时,阳极反应式为___________ 。
②写出阳极生成 的离子方程式
的离子方程式___________ 。
③电解结束时,通过导线的电量为Q(单位C),处理后污酸中As的残留量为___________ gL-1。(法拉第常数为F,表示每摩尔电子所带电量,单位Cmol-1)
(1)用化学用语表示烟气溶于水显酸性的原因
(2)采用铁碳床而非纯铁床的原因是
(3)配平下列方程式:
Fe+SO2+___________=H2S+___________+___________
(4)①铁碳床中铁碳比为1:1条件下处理污酸,As的去除率及质量浓度随反应时间变化如图所示。3h内,砷去除平均速率是

②污酸经过铁碳床处理后,再加入Na2SO3或通入SO2继续除砷,As的去除率变化如下图所示。

反应2h,砷去除率随Na2SO3质量的变化图通入0.64gSO2,砷去除率随反应时间的变化图甲同学认为,加入相同物质的量的Na2SO3和SO2,加入SO2时As的去除效率更好,相应的证据是
(5)处理后污酸中砷的残留量的测定:取处理后的污酸100mL,将其中的As全部转化为
 ,加入过量KI溶液和几滴淀粉溶液,用Pt电极进行电解,阳极附近溶液变蓝时,停止电解。电解过程中,阴极产生氢气,阳极产物与
,加入过量KI溶液和几滴淀粉溶液,用Pt电极进行电解,阳极附近溶液变蓝时,停止电解。电解过程中,阴极产生氢气,阳极产物与 反应,将其氧化为
反应,将其氧化为 ①电解时,阳极反应式为
①电解时,阳极反应式为②写出阳极生成
 的离子方程式
的离子方程式③电解结束时,通过导线的电量为Q(单位C),处理后污酸中As的残留量为
您最近一年使用:0次