名校
解题方法
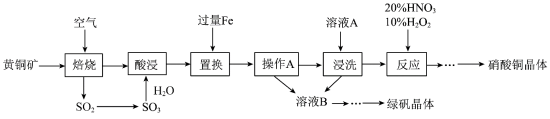
1 . 研究人员拟设计黄铜矿(主要含CuFeS2)制备硝酸铜和绿矾晶体的流程如下:
(1)CuFeS2中铁元素的化合价为___________ 价,已知“焙烧”生成SO2、CuO和Fe2O3,则其化学反应方程式为___________ 。
(2)“置换”步骤中发生的所有反应的离子方程式有___________ 、Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑。
(3)流程中“操作 A”所需的玻璃仪器有_____________ 。
(4)“浸洗”步骤中加溶液A 的目的是_______________ 。
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:___________ 。
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为_______________ 。
(1)CuFeS2中铁元素的化合价为
(2)“置换”步骤中发生的所有反应的离子方程式有
(3)流程中“操作 A”所需的玻璃仪器有
(4)“浸洗”步骤中加溶液A 的目的是
(5)“反应”步骤中,10%H2O2为氧化剂,20%HNO3提供H+,可以避免污染性气体的产生,写出该“反应”的离子方程式:
(6)绿矾晶体(FeSO4·7H2O)在空气中极易变质; 验证绿矾晶体已变质的操作为
您最近半年使用:0次
名校
解题方法
2 . Ⅰ.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融) 2Na+Cl2↑。回答下列问题:
2Na+Cl2↑。回答下列问题:
(1)保存金属钠的正确方法是___________(填字母)。
(2)Na、NaOH久置在空气中最终都是变为___________ (填化学式)。
(3)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为_______________ 。
Ⅱ. 是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。
(4) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与CO2反应的化学方程式
与CO2反应的化学方程式___________ 。
(5)将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(6)查阅资料知: 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
①已知 能发生如下反应:
能发生如下反应: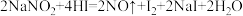 ,上述反应中氧化产物是
,上述反应中氧化产物是___________ ;HI在反应中体现了什么性质___________ 。
②根据上述反应鉴别 和NaCl,可选择以下物质中的
和NaCl,可选择以下物质中的___________ 进行实验(填序号)。
A.食用白醋 B.碘化钾淀粉试纸 C.淀粉 D.白酒
 2Na+Cl2↑。回答下列问题:
2Na+Cl2↑。回答下列问题:(1)保存金属钠的正确方法是___________(填字母)。
| A.放在棕色瓶中 | B.放在细沙中 | C.放在水中 | D.放在煤油中 |
(3)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为
Ⅱ.
 是重要的化工原料,具有多种用途。
是重要的化工原料,具有多种用途。(4)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 与CO2反应的化学方程式
与CO2反应的化学方程式(5)将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有(6)查阅资料知:
 在一定条件下可以转化为
在一定条件下可以转化为 ,
, 易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:
易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。请回答下列问题:①已知
 能发生如下反应:
能发生如下反应: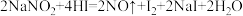 ,上述反应中氧化产物是
,上述反应中氧化产物是②根据上述反应鉴别
 和NaCl,可选择以下物质中的
和NaCl,可选择以下物质中的A.食用白醋 B.碘化钾淀粉试纸 C.淀粉 D.白酒
您最近半年使用:0次
名校
解题方法
3 . 综合题
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:___________ 。
(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。 中氮原子杂化方式
中氮原子杂化方式___________ ,该配合物中Fe3+配位数是___________ 。
②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为___________ (用含a、b的代数式表示)。
③第一步加入足量H2O2的目的是:___________ 。
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:___________ 。
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。___________ 。
(4)若该晶胞的边长为d nm,则该合金的密度为___________  。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)
(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为___________ L。
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO
 )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫
 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。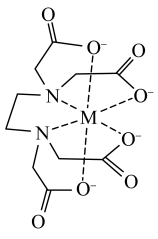
 中氮原子杂化方式
中氮原子杂化方式②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为
③第一步加入足量H2O2的目的是:
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。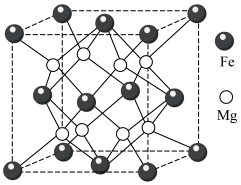
(4)若该晶胞的边长为d nm,则该合金的密度为
 。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为
您最近半年使用:0次
4 . 氧钒(Ⅳ)碱式碳酸铵晶体{化学式为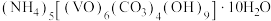 ,
,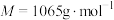 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:

 溶液
溶液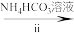 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为_____ ,第二步电离方程式为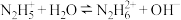 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:_____ 。
(2)步骤ii可通过如图装置完成。 的优点为
的优点为_____ ,检查其气密性的操作为_____ 。
②实验开始时,先打开_____ (填“K1”或“K2”)。
③盛装NH4HCO3溶液的仪器名称为_____ 。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg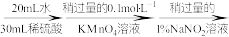
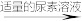
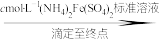 再重复实验两次。
再重复实验两次。
已知: 。
。
①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:_____ 。
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_____  。
。
③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
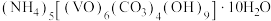 ,
,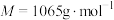 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
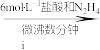
 溶液
溶液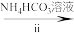 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为
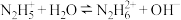 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:(2)步骤ii可通过如图装置完成。
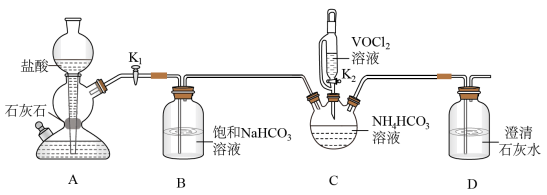
 的优点为
的优点为②实验开始时,先打开
③盛装NH4HCO3溶液的仪器名称为
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg
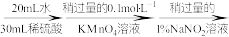
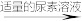
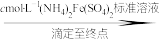 再重复实验两次。
再重复实验两次。已知:
 。
。①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
 。
。③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果
您最近半年使用:0次
7日内更新
|
181次组卷
|
2卷引用:河北省邢台市2024届高三下学期质量检测一模化学试题
解题方法
5 . 某工厂的固体废渣中主要含 和
和 ,还含有少量
,还含有少量 和
和 。
。
利用该固体废渣制取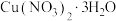 的部分工艺流程如图所示:
的部分工艺流程如图所示: 属于碱性氧化物;
属于碱性氧化物; 在酸性溶液中不稳定,会转变为
在酸性溶液中不稳定,会转变为 和
和 。
。
② 是酸性氧化物,难于水和酸。
是酸性氧化物,难于水和酸。
(1)若中和时加入的 恰好完全反应,则过滤后所得废渣的成分为
恰好完全反应,则过滤后所得废渣的成分为________ 。
(2) 与稀硝酸反应时,硝酸体现出的性质:
与稀硝酸反应时,硝酸体现出的性质:________ 。
(3)酸溶时,反应温度不宜超过 ,其主要原因是
,其主要原因是________ 。
(4)写出 与稀硝酸反应的离子方程式:
与稀硝酸反应的离子方程式:________ 。
(5)已知: 的溶解度曲线如图所示
的溶解度曲线如图所示 )为原料,制取
)为原料,制取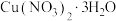 晶体的操作流程如下:
晶体的操作流程如下:
先向工业废水中加入 溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,
溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,_________ ,_________ ,(填操作名称)过滤,洗涤,干燥,即制得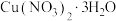 晶体。
晶体。
 和
和 ,还含有少量
,还含有少量 和
和 。
。利用该固体废渣制取
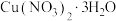 的部分工艺流程如图所示:
的部分工艺流程如图所示:
 属于碱性氧化物;
属于碱性氧化物; 在酸性溶液中不稳定,会转变为
在酸性溶液中不稳定,会转变为 和
和 。
。②
 是酸性氧化物,难于水和酸。
是酸性氧化物,难于水和酸。(1)若中和时加入的
 恰好完全反应,则过滤后所得废渣的成分为
恰好完全反应,则过滤后所得废渣的成分为(2)
 与稀硝酸反应时,硝酸体现出的性质:
与稀硝酸反应时,硝酸体现出的性质:(3)酸溶时,反应温度不宜超过
 ,其主要原因是
,其主要原因是(4)写出
 与稀硝酸反应的离子方程式:
与稀硝酸反应的离子方程式:(5)已知:
 的溶解度曲线如图所示
的溶解度曲线如图所示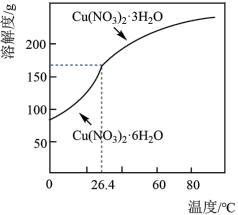
 )为原料,制取
)为原料,制取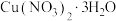 晶体的操作流程如下:
晶体的操作流程如下:先向工业废水中加入
 溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,
溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,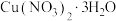 晶体。
晶体。
您最近半年使用:0次
6 .  是新一代饮用水的消毒剂,许多发达国家的自来水厂采用
是新一代饮用水的消毒剂,许多发达国家的自来水厂采用  代替
代替  来进行自来水消毒,我国最近成功研制出制取
来进行自来水消毒,我国最近成功研制出制取  的新方法,其反应的微观过程如图所示
的新方法,其反应的微观过程如图所示
 是新一代饮用水的消毒剂,许多发达国家的自来水厂采用
是新一代饮用水的消毒剂,许多发达国家的自来水厂采用  代替
代替  来进行自来水消毒,我国最近成功研制出制取
来进行自来水消毒,我国最近成功研制出制取  的新方法,其反应的微观过程如图所示
的新方法,其反应的微观过程如图所示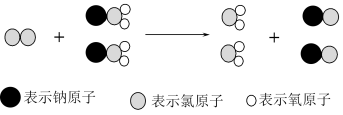
| A.该反应是复分解反应 |
B.该反应的化学方程式为  |
| C.反应过程中存在共价键、离子键的断裂与形成 |
D.生成 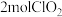 时转移的电子数为 时转移的电子数为 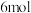 |
您最近半年使用:0次
名校
解题方法
7 . 下列有关海水综合利用涉及的离子方程式不正确的是
A.利用石灰乳沉镁: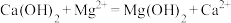 |
B.利用 溶液反萃取 溶液反萃取 中的 中的 : :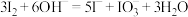 |
C.利用 吸收 吸收 二次富集溴: 二次富集溴: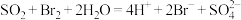 |
D.电解饱和食盐水: |
您最近半年使用:0次
解题方法
8 . 氯酸镁[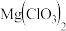 ]常用作催熟剂、除草剂等,实验室制备少量
]常用作催熟剂、除草剂等,实验室制备少量 的流程如下:
的流程如下: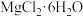 ,含有
,含有 、
、 等杂质。
等杂质。
②四种化合物的溶解度 随温度
随温度 变化曲线如图2所示。
变化曲线如图2所示。
(1)加速卤块在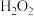 溶液中溶解的措施有:
溶液中溶解的措施有:_______ (任写一点)。
(2)加入 的作用是
的作用是_______ ,滤渣的成分_______ ,此时滤液中c(Fe3+) = ______ mol/L。(已知: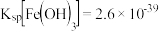 )
)
(3)加入 饱和溶液后发生反应的化学方程式为
饱和溶液后发生反应的化学方程式为________ (溶解度低的物质以沉淀形式析出),再进一步制 晶体的实验步骤依次为:
晶体的实验步骤依次为:
①加热蒸发;②_______ ;①______ ;④过滤洗涤。
产品中 含量的测定:
含量的测定:
步骤 :准确称量
:准确称量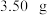 产品配成
产品配成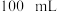 溶液。
溶液。
步骤 :取
:取 试液于锥形瓶中,加入
试液于锥形瓶中,加入 稀硫酸和
稀硫酸和 的
的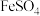 溶液,微热。
溶液,微热。
步骤 :冷却至室温,用
:冷却至室温,用 溶液滴定剩余的
溶液滴定剩余的 至终点。此过程中反应的离子方程式为:
至终点。此过程中反应的离子方程式为: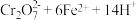 →
→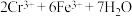 。
。
步骤 :将步骤
:将步骤 、
、 重复两次
重复两次
(4)①写出步骤 中发生反应的离子方程式:
中发生反应的离子方程式:________ 。
②步骤 中若滴定前不用标准液润洗滴定管,将会导致最终结果
中若滴定前不用标准液润洗滴定管,将会导致最终结果_____  填“偏大”、“偏小”或“不变”
填“偏大”、“偏小”或“不变” ;
;
(5)若平均消耗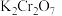 溶液
溶液 ,则产品中
,则产品中 的质量分数为
的质量分数为_______ 。(写出必要的计算过程)
 ]常用作催熟剂、除草剂等,实验室制备少量
]常用作催熟剂、除草剂等,实验室制备少量 的流程如下:
的流程如下: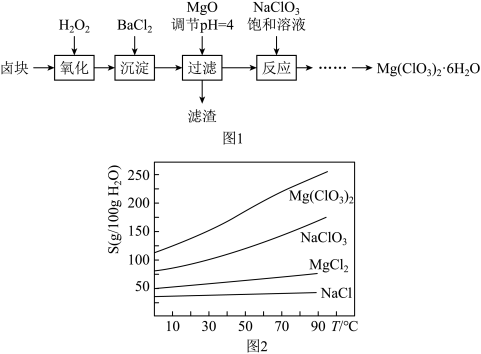
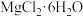 ,含有
,含有 、
、 等杂质。
等杂质。②四种化合物的溶解度
 随温度
随温度 变化曲线如图2所示。
变化曲线如图2所示。(1)加速卤块在
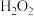 溶液中溶解的措施有:
溶液中溶解的措施有:(2)加入
 的作用是
的作用是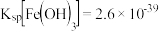 )
)(3)加入
 饱和溶液后发生反应的化学方程式为
饱和溶液后发生反应的化学方程式为 晶体的实验步骤依次为:
晶体的实验步骤依次为:①加热蒸发;②
产品中
 含量的测定:
含量的测定:步骤
 :准确称量
:准确称量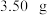 产品配成
产品配成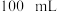 溶液。
溶液。步骤
 :取
:取 试液于锥形瓶中,加入
试液于锥形瓶中,加入 稀硫酸和
稀硫酸和 的
的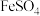 溶液,微热。
溶液,微热。步骤
 :冷却至室温,用
:冷却至室温,用 溶液滴定剩余的
溶液滴定剩余的 至终点。此过程中反应的离子方程式为:
至终点。此过程中反应的离子方程式为: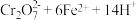 →
→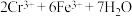 。
。步骤
 :将步骤
:将步骤 、
、 重复两次
重复两次(4)①写出步骤
 中发生反应的离子方程式:
中发生反应的离子方程式:②步骤
 中若滴定前不用标准液润洗滴定管,将会导致最终结果
中若滴定前不用标准液润洗滴定管,将会导致最终结果 填“偏大”、“偏小”或“不变”
填“偏大”、“偏小”或“不变” ;
;(5)若平均消耗
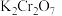 溶液
溶液 ,则产品中
,则产品中 的质量分数为
的质量分数为
您最近半年使用:0次
解题方法
9 . 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业氧化锌[含有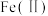 、
、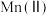 、
、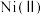 等杂质]的流程如下
等杂质]的流程如下


已知:①在本实验条件下,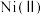 不能被氧化;高锰酸钾的还原产物是
不能被氧化;高锰酸钾的还原产物是 。
。
②不考虑操作过程中引起的质量损失。
回答下列问题:
(1)加稀硫酸酸浸时,常将工业 粉碎,其目的是
粉碎,其目的是_____ 。
(2)过滤时,主要用到的玻璃仪器有烧杯、玻璃棒和________ ,其中玻璃棒的作用为_________ 。
(3)②发生反应的离子方程式有 和
和________ 。
(4)若④中产物仅为 ,则发生反应的离子方程式为
,则发生反应的离子方程式为________ ;取干燥后的滤饼 ,煅烧后可得到产品(
,煅烧后可得到产品( )
) ,则
,则 等于
等于_____ (用含a、m的代数式表示)。
(5)④形成的沉淀要水洗,检验沉淀是否洗涤干净的操作和现象是________ 。
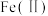 、
、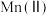 、
、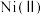 等杂质]的流程如下
等杂质]的流程如下

已知:①在本实验条件下,
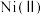 不能被氧化;高锰酸钾的还原产物是
不能被氧化;高锰酸钾的还原产物是 。
。②不考虑操作过程中引起的质量损失。
回答下列问题:
(1)加稀硫酸酸浸时,常将工业
 粉碎,其目的是
粉碎,其目的是(2)过滤时,主要用到的玻璃仪器有烧杯、玻璃棒和
(3)②发生反应的离子方程式有
 和
和(4)若④中产物仅为
 ,则发生反应的离子方程式为
,则发生反应的离子方程式为 ,煅烧后可得到产品(
,煅烧后可得到产品( )
) ,则
,则 等于
等于(5)④形成的沉淀要水洗,检验沉淀是否洗涤干净的操作和现象是
您最近半年使用:0次
10 . 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)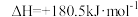 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的
____ 。
(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。____ 。
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为____ 。
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。_____ 。
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是____ 。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)
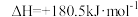 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的

(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。
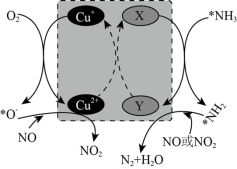
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。
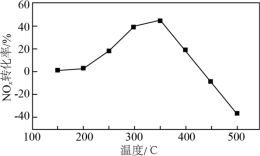
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是
您最近半年使用:0次



