解题方法
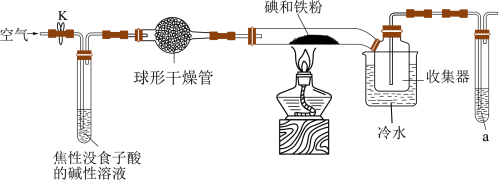
1 . 碘化亚铁(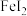 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)_______ ,若无此装置,写出铁粉参与的副反应的化学方程式:_______ ,硬质玻璃管中制备碘化亚铁的化学方程式为_______ 。
(2)硬质玻璃管直接接入收集器而不用导管的原因是_______ ,收集器浸泡在冷水中的原因是_______ 。
(3)试剂a的作用是_______ 。
(4)已知氧化性: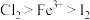 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:_______ 。
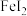 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)
(2)硬质玻璃管直接接入收集器而不用导管的原因是
(3)试剂a的作用是
(4)已知氧化性:
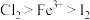 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:
您最近半年使用:0次
解题方法
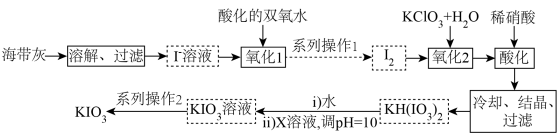
2 . 1833年,布森戈提出用富含碘的盐治疗甲肿,这是第一位提出向盐中添加碘防治甲肿的人。我国政府规定:碘盐添加KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图所示。
(1) KIO3属于__________ (填“酸”“碱”“盐”或“氧化物”),其中I的化合价为__________ 价。
(2)“氧化1”中发生反应的离子方程式为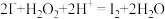 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:______________ ,该氧化过程中需要控制温度不宜过高,其原因是______________ 。系列操作2包括蒸发浓缩_______________ 过滤、乙醇洗涤、干燥等。
(3)X的化学式为______________ 。
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应: (未配平)。
(未配平)。
①根据上述数据,测得产品中碘元素质量分数为__________ (用含w、c、V的表达式表示)。
②如果将稀硫酸换成稀硝酸,则测得结果会__________ (填“偏高”“偏低”或“无影响”)。
(1) KIO3属于
(2)“氧化1”中发生反应的离子方程式为
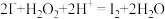 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:(3)X的化学式为
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应:
 (未配平)。
(未配平)。①根据上述数据,测得产品中碘元素质量分数为
②如果将稀硫酸换成稀硝酸,则测得结果会
您最近半年使用:0次
3 . 已知R为短周期主族元素,一种白色钠盐M的组成用通式 表示。为了探究R元素,进行如下实验:
表示。为了探究R元素,进行如下实验:
(1)若在M溶液中滴加 溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为
溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为__________ ,M的俗名是__________ 。
(2)若在M溶液中滴加 溶液,生成白色胶状物质,该白色胶状物质的化学式为
溶液,生成白色胶状物质,该白色胶状物质的化学式为______________ 。
(3)若将M溶液加入酸性 溶液中,酸性
溶液中,酸性 溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是
溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是__________ ,则M溶液和酸性 溶液反应使其溶液褪色的离子方程式为
溶液反应使其溶液褪色的离子方程式为________ ,其中还原剂是__________ 。
(4)若在M溶液中加入铜粉,无明显现象,滴加适量稀硫酸,铜粉溶解,溶液变蓝色,生成气体X,将X与单质Y通入足量水中恰好发生化合反应,则同温同压下X与Y的体积比为________ ,铜粉溶解的离子方程式为____________ ,工业上,氨催化氧化可制备X,其反应的化学方程式为__________ 。
 表示。为了探究R元素,进行如下实验:
表示。为了探究R元素,进行如下实验:(1)若在M溶液中滴加
 溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为
溶液,产生白色沉淀,过滤,在白色沉淀中滴加过量的盐酸,产生无色无味气体,白色沉淀完全溶解。则M的阴离子符号为(2)若在M溶液中滴加
 溶液,生成白色胶状物质,该白色胶状物质的化学式为
溶液,生成白色胶状物质,该白色胶状物质的化学式为(3)若将M溶液加入酸性
 溶液中,酸性
溶液中,酸性 溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是
溶液褪色;在M中滴加盐酸生成一种无色、有刺激性气味的气体,将该气体通入品红溶液中,品红溶液褪色,加热褪色的品红溶液,可能观察到的现象是 溶液反应使其溶液褪色的离子方程式为
溶液反应使其溶液褪色的离子方程式为(4)若在M溶液中加入铜粉,无明显现象,滴加适量稀硫酸,铜粉溶解,溶液变蓝色,生成气体X,将X与单质Y通入足量水中恰好发生化合反应,则同温同压下X与Y的体积比为
您最近半年使用:0次
解题方法
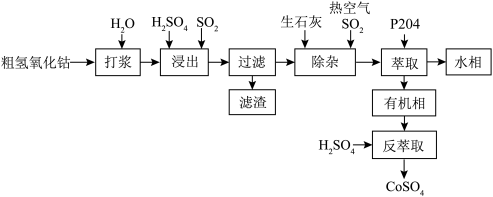
4 . 粗氢氧化钴Co(OH)3是以铜钴矿为原料湿法提取而得到的粗制钴盐中间品,含有MnOOH以及Al2O3、Fe3O4、Mg等杂质,粗氢氧化钴湿法制取精制硫酸钴流程如下:_______ (填元素名称)进行有效浸出。保持温度, 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为_______ mol/L。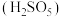 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ (已知: 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
_______ (保留一位小数)时,检验反应后的滤液中恰好不存在 (已知:
(已知: 的
的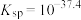 ,离子浓度
,离子浓度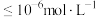 时沉淀完全)。
时沉淀完全)。
(3)在萃取剂一定量的情况下,提高萃取率的措施有_______ (答出一点即可),萃取后水相溶液中存在的金属离子有_______ 。
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是_______ 。
 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为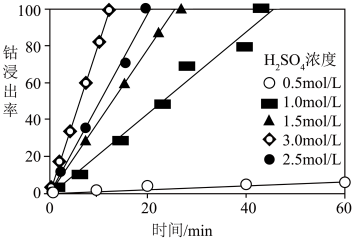
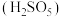 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
 (已知:
(已知: 的
的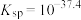 ,离子浓度
,离子浓度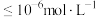 时沉淀完全)。
时沉淀完全)。(3)在萃取剂一定量的情况下,提高萃取率的措施有
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是

您最近半年使用:0次
名校
解题方法
5 .  是重要的化工原料。如图为实验室中制取粗
是重要的化工原料。如图为实验室中制取粗 产品的装置,夹持装置略去。
产品的装置,夹持装置略去。
经查阅资料知:红磷与少量 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成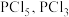 遇水会强烈水解生成
遇水会强烈水解生成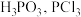 遇
遇 会生成
会生成 的熔沸点见上表。
的熔沸点见上表。
回答下列问题:
(1)仪器F的名称是___________ ,装置G中反应的化学方程式为___________ 。
(2)实验时,检查装置气密性后,先打开 通入
通入 一段时间,再迅速加入红磷。通入
一段时间,再迅速加入红磷。通入 的作用是
的作用是___________ 。
(3)装置C中的反应需要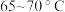 ,温度不宜过高和过低的原因是
,温度不宜过高和过低的原因是___________ ,最适合的加热方式为___________ (填“水浴”或“油浴”)加热。
(4)制得的 粗产品中常含有
粗产品中常含有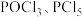 等。加入红磷加热除去
等。加入红磷加热除去 后,通过
后,通过___________ (填实验操作名称),即可得到较纯净的 。
。
(5)通过实验测定粗产品中 的质量分数,实验步骤如下(不考虑杂质的反应):
的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取 粗产品,加水完全水解;
粗产品,加水完全水解;
第二步:配成 溶液,移取
溶液,移取 溶液置于锥形瓶中;
溶液置于锥形瓶中;
第三步:加入 碘溶液
碘溶液 ,反应完全;
,反应完全;
第四步:加入几滴淀粉溶液,用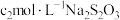 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液
标准溶液 。
。
判断滴定达到终点时的现象是___________ ,粗产品中 的质量分数表达式为
的质量分数表达式为___________ 。(已知:①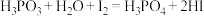 ;②
;② )
)
 是重要的化工原料。如图为实验室中制取粗
是重要的化工原料。如图为实验室中制取粗 产品的装置,夹持装置略去。
产品的装置,夹持装置略去。
| 物质 | 熔点 | 沸点 |
 |  | 75.5 |
 | 2 | 105.3 |
 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成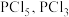 遇水会强烈水解生成
遇水会强烈水解生成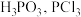 遇
遇 会生成
会生成 的熔沸点见上表。
的熔沸点见上表。回答下列问题:
(1)仪器F的名称是
(2)实验时,检查装置气密性后,先打开
 通入
通入 一段时间,再迅速加入红磷。通入
一段时间,再迅速加入红磷。通入 的作用是
的作用是(3)装置C中的反应需要
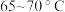 ,温度不宜过高和过低的原因是
,温度不宜过高和过低的原因是(4)制得的
 粗产品中常含有
粗产品中常含有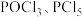 等。加入红磷加热除去
等。加入红磷加热除去 后,通过
后,通过 。
。(5)通过实验测定粗产品中
 的质量分数,实验步骤如下(不考虑杂质的反应):
的质量分数,实验步骤如下(不考虑杂质的反应):第一步:迅速移取
 粗产品,加水完全水解;
粗产品,加水完全水解;第二步:配成
 溶液,移取
溶液,移取 溶液置于锥形瓶中;
溶液置于锥形瓶中;第三步:加入
 碘溶液
碘溶液 ,反应完全;
,反应完全;第四步:加入几滴淀粉溶液,用
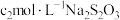 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液
标准溶液 。
。判断滴定达到终点时的现象是
 的质量分数表达式为
的质量分数表达式为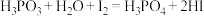 ;②
;② )
)
您最近半年使用:0次
名校
解题方法
6 . CI4分)某化学小组欲测定酸性条件下 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为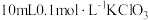 溶液和
溶液和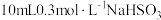 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2:_____ 。
 (已配平)
(已配平)
(2)根据实验数据可知,该反应在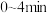 的平均反应速率
的平均反应速率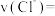
_____ 。
(3)下列说法正确的是_____
A.若纵坐标为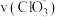 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合
B.图中阴影部分的面积表示 时间内
时间内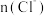 的增大
的增大
C.后期反应速率下降的主要原因是反应物浓度减少
(4)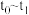 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
已知: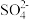 对该反应无影响;
对该反应无影响;
可供选择的试剂有:A. 固体 B.
固体 B. 固体C.
固体C. D.
D.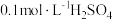 E.
E.
①方案I中所选试剂_____ ,方案Ⅱ中所选试剂_____ 。
②方案Ⅱ烧杯①中加入 水的作用是
水的作用是_____ 。
③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设_____ 。
 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为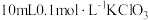 溶液和
溶液和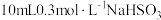 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2: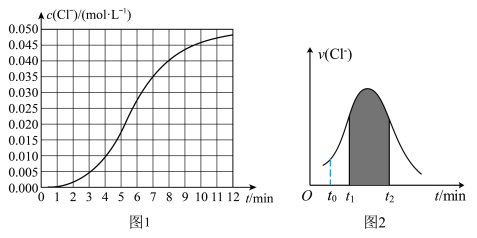
 (已配平)
(已配平)(2)根据实验数据可知,该反应在
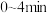 的平均反应速率
的平均反应速率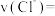
(3)下列说法正确的是
A.若纵坐标为
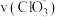 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合B.图中阴影部分的面积表示
 时间内
时间内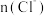 的增大
的增大C.后期反应速率下降的主要原因是反应物浓度减少
(4)
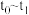 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:已知:
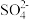 对该反应无影响;
对该反应无影响;可供选择的试剂有:A.
 固体 B.
固体 B. 固体C.
固体C. D.
D.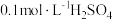 E.
E.
| 方案 | 假设 | 数据处理 | 具体实验操作 |
| I | 反应产物 对反应有催化作用,加快了化学反应速率 对反应有催化作用,加快了化学反应速率 | 取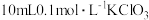 溶液于烧杯中,先加入_____(填字母),再加入 溶液于烧杯中,先加入_____(填字母),再加入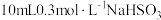 溶液。 溶液。 | 绘制溶液中 浓度 浓度 随时间变化的曲线与图1对比 随时间变化的曲线与图1对比 |
| Ⅱ | 反应中溶液酸性增强,加快了化学反应速率 | 分别向两个烧杯中加入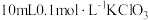 溶液。 溶液。烧杯①:加入  水: 水:烧杯②:加入  _____(填字母)。 _____(填字母)。再分别向两个烧杯中加入 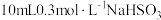 溶液。 溶液。 |
②方案Ⅱ烧杯①中加入
 水的作用是
水的作用是③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设
您最近半年使用:0次
名校
解题方法
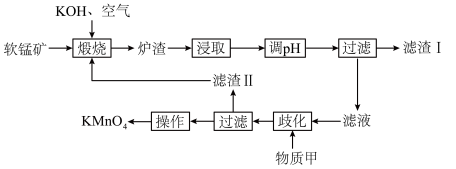
7 . 高锰酸钾为常见的强氧化剂,常用于消毒杀菌。工业上常以软锰矿(主要成分为MnO2,含少量Si、Al的氧化物)为原料制备,流程如下:
回答下列问题:
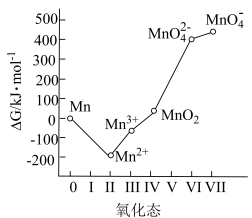
(1)基态Mn2+的价电子轨道表示式为___________ 。K2MnO4中Mn的化合价为___________ 。
(2)煅烧后,炉渣主要成分为K2MnO4,写出MnO2发生的化学方程式___________ 。
(3)浸取后通入CO2调节pH,则滤渣Ⅰ的主要成分为___________ 、___________ 。
(4)流程中的“歧化”可加入的物质甲是___________(填字母)。
(5)歧化时发生的离子方程式为___________ 。
(6)实验室常用草酸标准溶液测定产品中高锰酸钾的纯度。取0.5000g样品溶于水,配成100mL溶液,取10.00mL于锥形瓶中,滴入5滴稀硫酸酸化,用0.1500mol/L草酸标准溶液滴定,达终点时消耗标准液5.100mL。
①滴定终点的现象为___________ 。
②样品中高锰酸钾(摩尔质量为158g·mol-1)的纯度为___________ %(结果保留小数点后两位)。
回答下列问题:
(1)基态Mn2+的价电子轨道表示式为
(2)煅烧后,炉渣主要成分为K2MnO4,写出MnO2发生的化学方程式
(3)浸取后通入CO2调节pH,则滤渣Ⅰ的主要成分为
(4)流程中的“歧化”可加入的物质甲是___________(填字母)。
| A.亚硫酸 | B.浓盐酸 | C.乙二酸 | D.稀硫酸 |
(5)歧化时发生的离子方程式为
(6)实验室常用草酸标准溶液测定产品中高锰酸钾的纯度。取0.5000g样品溶于水,配成100mL溶液,取10.00mL于锥形瓶中,滴入5滴稀硫酸酸化,用0.1500mol/L草酸标准溶液滴定,达终点时消耗标准液5.100mL。
①滴定终点的现象为
②样品中高锰酸钾(摩尔质量为158g·mol-1)的纯度为
您最近半年使用:0次
名校
解题方法
8 . 钼(Mo)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
(1) 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
(3) 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为_______ ,结合图1中信息说明理由:_______ 。 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为_______ (填标号)。
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为: ,放电时负极的电极反应式为
,放电时负极的电极反应式为_______ 。
 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
(1)
 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为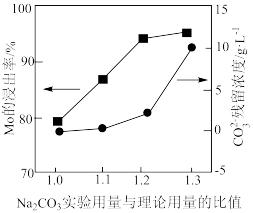
 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为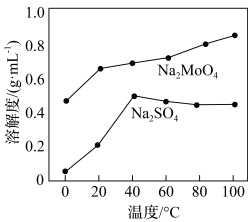
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为:
 ,放电时负极的电极反应式为
,放电时负极的电极反应式为
您最近半年使用:0次
解题方法
9 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为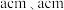 和
和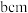 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为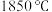 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
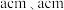 和
和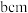 ,结构如下图所示。
,结构如下图所示。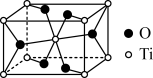
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
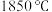 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
解题方法
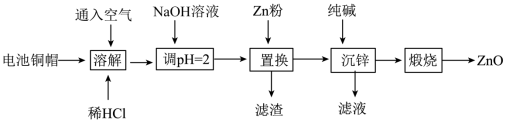
10 . 实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的实验流程如下:___________ 。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是___________ 。
(3)用NaOH溶液调节pH=2的目的是___________ 。
(4)滤渣中的主要物质是___________ (填化学式)。
(5)“沉锌”时生成碱式碳酸锌[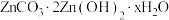 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。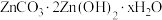 中x的值为
中x的值为___________ (写出计算过程)。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是
(3)用NaOH溶液调节pH=2的目的是
(4)滤渣中的主要物质是
(5)“沉锌”时生成碱式碳酸锌[
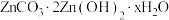 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。
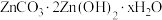 中x的值为
中x的值为
您最近半年使用:0次



