1 . 硼是第ⅢA族中唯一的非金属元素,可以形成众多的化合物。回答下列问题:
(1)硼烷泛指一切硼和氢组成的化合物。乙硼烷( )是最简单的硼烷,可以在
)是最简单的硼烷,可以在_______ (填“乙酸”或“乙醚”或“水”)介质中使用 还原
还原 获得,
获得, 的电子式为
的电子式为_______ ,制备乙硼烷的化学方程式为_______ 。 )的溶解度
)的溶解度
(2)操作1是蒸发浓缩、冷却结晶、过滤、_______ ,干燥;整个流程中可循环利用的物质是_______ 。
(3)硼酸( )是一元弱酸,在溶液中存在平衡:
)是一元弱酸,在溶液中存在平衡: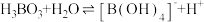 (常温下:
(常温下: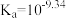 ),
), 与NaOH溶液反应可制备硼砂。常温下,在
与NaOH溶液反应可制备硼砂。常温下,在 硼砂溶液中,
硼砂溶液中,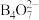 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液pH=
,该溶液pH=_______ 。常温常压下,硼酸( )晶体结构为层状,其二维平面结构如图所示:
)晶体结构为层状,其二维平面结构如图所示:_______ 。
(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化合物,其原因为_______ 。
(1)硼烷泛指一切硼和氢组成的化合物。乙硼烷(
 )是最简单的硼烷,可以在
)是最简单的硼烷,可以在 还原
还原 获得,
获得, 的电子式为
的电子式为
 )的溶解度
)的溶解度| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 80 |
| 溶解度/g | 2.77 | 3.65 | 4.87 | 6.77 | 8.90 | 23.54 |
(2)操作1是蒸发浓缩、冷却结晶、过滤、
(3)硼酸(
 )是一元弱酸,在溶液中存在平衡:
)是一元弱酸,在溶液中存在平衡: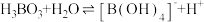 (常温下:
(常温下: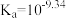 ),
), 与NaOH溶液反应可制备硼砂。常温下,在
与NaOH溶液反应可制备硼砂。常温下,在 硼砂溶液中,
硼砂溶液中,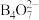 水解生成等物质的量浓度的
水解生成等物质的量浓度的 和
和 ,该溶液pH=
,该溶液pH= )晶体结构为层状,其二维平面结构如图所示:
)晶体结构为层状,其二维平面结构如图所示: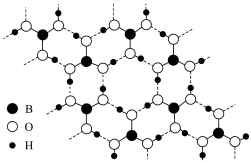
H3BO3的层状结构
从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:(4)相关化学键的键能如下表所示,简要分析和解释下列事实。
| 化学键 |  |  |  |
键能( ) ) | 389 | 561 | 293 |
您最近一年使用:0次
名校
解题方法
2 . 氧化钪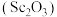 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪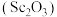 的一种流程如下图。
的一种流程如下图。
(1)基态钪原子的价层电子排布式为___________ 。
(2)“萃取”时,钛白工业废酸中加入 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的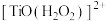 ,其中
,其中 的作用是
的作用是___________ (填标号)。
A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用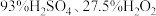 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的___________ 、___________ 。
(4)萃取剂萃取 的原理为
的原理为 (
(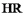 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成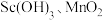 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为___________ 。 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为___________  (已知:
(已知: 时,
时, 。
。
(5)“沉钪”时用到草酸。已知草酸的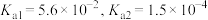 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中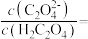
___________ 。
(6)在空气中焙烧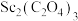 的化学方程式为
的化学方程式为___________ 。
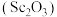 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪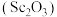 的一种流程如下图。
的一种流程如下图。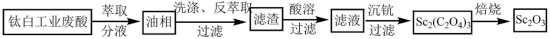
(1)基态钪原子的价层电子排布式为
(2)“萃取”时,钛白工业废酸中加入
 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的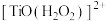 ,其中
,其中 的作用是
的作用是A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用
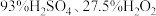 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将A试剂沿烧杯内壁缓慢注入B试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入C试剂中,并不断搅拌,则A、C分别对应上述试剂中的(4)萃取剂萃取
 的原理为
的原理为 (
(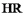 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成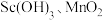 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为 (已知:
(已知: 时,
时, 。
。(5)“沉钪”时用到草酸。已知草酸的
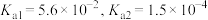 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中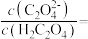
(6)在空气中焙烧
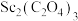 的化学方程式为
的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . Ⅰ、按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是___________。
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=___________ mol·L−1。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:___________ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和H2平衡转化率的措施:___________ 。
③保证该压强不变,向T1温度下, =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(1)常温下,有关下列四种溶液的说法正确的是___________。
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
C.①与③混合,若溶液pH=7,则溶液中c(NH )>c(Cl-) )>c(Cl-) |
| D.②与④等体积混合,混合溶液的pH>7 |
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示: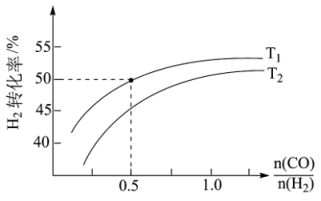
②写出一条可同时提高反应速率和H2平衡转化率的措施:
③保证该压强不变,向T1温度下,
 =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
您最近一年使用:0次
解题方法
4 . 二氧化硫是一种使人们爱恨交加的物质,爱其作为一种化工原料,为人类提供物质基础,恨其有毒,对人类即环境的危害。联系工业生产中用碱液吸收含 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: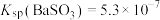 。
。
(1)利用85%的浓硫酸和 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。
(2) 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。
某同学查阅资料:常温时, ,
,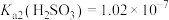 。
。
某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是________ (填微粒化学式)。
(3)“性质实验装置”中将 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀:________________ ;有同学结合“性质实验”反应物的组成及性质推断该沉淀为 ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是________________ 。请你设计实验探究该反应的生成物是 ,而不是
,而不是 :
:________________ 。
(4)在“性质实验装置”中制备少量硫代硫酸钠( ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为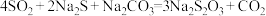 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中 、
、 的质量变化关系如下图:
的质量变化关系如下图: 的生成量曲线为
的生成量曲线为________ (填“甲”或“乙”),曲线乙Q点后出现急剧下降的原因是________ 。
(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用________ 。
 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: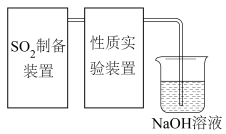
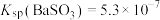 。
。(1)利用85%的浓硫酸和
 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。A.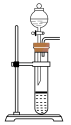 | B. | C.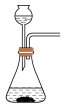 | D.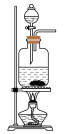 |
(2)
 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。某同学查阅资料:常温时,
 ,
,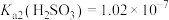 。
。某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的
 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是(3)“性质实验装置”中将
 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀: ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是 ,而不是
,而不是 :
:(4)在“性质实验装置”中制备少量硫代硫酸钠(
 ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为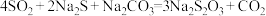 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中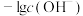 、
、 的质量变化关系如下图:
的质量变化关系如下图: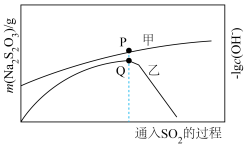
 的生成量曲线为
的生成量曲线为(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用
您最近一年使用:0次
5 . Ⅰ.太空很神秘,水的世界也深不可测,从水作溶剂、水分子运动到水的电离、水与活泼金属反应等等。结合书本知识,回答下列问题:
(1)标准状况下,0.01 的NaOH溶液的pH
的NaOH溶液的pH_______ (填“>”“<”或“=”,下同)12,该温度下,水的离子积常数
_______  。
。
(2)T℃下,水的离子积曲线如图所示。_______ (填字母)。
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将 L pH=a NaOH溶液与
L pH=a NaOH溶液与 L
L 硫酸混合。
硫酸混合。
若所得混合溶液呈中性,且a=12,b=1,则
_______ ;若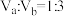 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=_______ 。
(3)现有以下五种电解质溶液,回答下列问题:
① ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是_______ (填序号)。
②浓度均为0.1 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为_______ (填序号)。
Ⅱ. 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
回答下列问题:
(4)常温下,下列事实能说明 是弱电解质的是
是弱电解质的是_______ (填写序号)
① 与水能以任意比互溶
与水能以任意比互溶
②0.1mol/L 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱
③常温下pH=3的 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4
④ 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大
⑥大小相同的锌片与同体积同浓度的盐酸和 反应,产生
反应,产生 的物质的量相同
的物质的量相同
(5)已知 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=_______ 。用水缓慢稀释该氨水的过程中,溶液中随着水量的增加,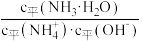
_______ 。(填“增大”“减小”或“不变”)
(1)标准状况下,0.01
 的NaOH溶液的pH
的NaOH溶液的pH
 。
。(2)T℃下,水的离子积曲线如图所示。
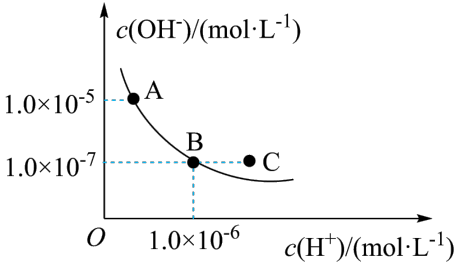
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将
 L pH=a NaOH溶液与
L pH=a NaOH溶液与 L
L 硫酸混合。
硫酸混合。若所得混合溶液呈中性,且a=12,b=1,则

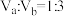 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=(3)现有以下五种电解质溶液,回答下列问题:
①
 ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1
 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是②浓度均为0.1
 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为Ⅱ.
 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:| 物质 |  |  |  |
| 电离常数 | 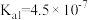 , ,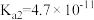 | 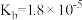 |  |
(4)常温下,下列事实能说明
 是弱电解质的是
是弱电解质的是①
 与水能以任意比互溶
与水能以任意比互溶②0.1mol/L
 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱③常温下pH=3的
 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4④
 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向
 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大⑥大小相同的锌片与同体积同浓度的盐酸和
 反应,产生
反应,产生 的物质的量相同
的物质的量相同(5)已知
 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=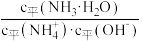
您最近一年使用:0次
名校
解题方法
6 . 化学上的缓冲溶液就是外加少量酸、碱后而pH值基本不变的溶液。
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式___________ 、___________ 。
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为___________ ,反应后溶液中c(H+)=___________ mol/L。
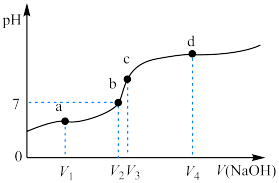
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为___________ ;c点恰好完全反应,该处溶液呈碱性的原因为___________ 。
4.CO2的电子式为___________ ,其分子极性为___________ ;电负性C___________ Si(填“>”“=”或者“<”)。
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是___________ 。
a.代谢产生的H+被 结合形成H2CO3
结合形成H2CO3
b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为
4.CO2的电子式为
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是
a.代谢产生的H+被
 结合形成H2CO3
结合形成H2CO3b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
您最近一年使用:0次
名校
解题方法
7 . 锰元素在一些有机物的氧化过程中会以中间体形式出现一种美丽的亮蓝色离子MnO (次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(1)次锰酸根离子MnO 中Mn的化合价为
中Mn的化合价为___________ 。
(2)“焙烧”过程中的氧化剂为___________ 、___________ (填化学式)。
(3)“除铝”过程中的离子方程式为___________ 。
(4)“滤渣2”的主要成分为___________ 、___________ (填化学式)。
(5)“沉锰”时,Mn2+会转化为MnCO3.若常温下控制溶液pH=8,且最终c(HCO )=0.1 mol·L-1,则此时溶液中c(Mn2+)=
)=0.1 mol·L-1,则此时溶液中c(Mn2+)=___________ mol·L-1。
(6)在“共熔”过程中,需要向煅烧后产生的MnO2固体中添加一定比例的NaNO3、NaOH,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为___________ 。
 (次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下:
(次锰酸根离子)。工业上可用低品位锰矿(主要成分MnO2,含Fe、Al、Ni等元素的杂质)与废FeSO4经过一系列转化得到高品位MnO2,同时继续制备次锰酸盐,流程如下: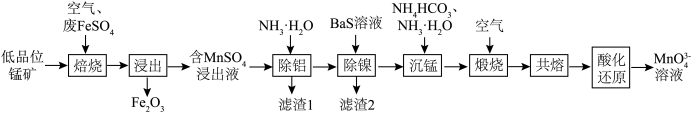
| 物质 | MnCO3 | H2CO3 |
| 25℃数值 | Ksp=2.0×10-11 | Ka1=4×10-7 Ka2=5×10-11 |
(1)次锰酸根离子MnO
 中Mn的化合价为
中Mn的化合价为(2)“焙烧”过程中的氧化剂为
(3)“除铝”过程中的离子方程式为
(4)“滤渣2”的主要成分为
(5)“沉锰”时,Mn2+会转化为MnCO3.若常温下控制溶液pH=8,且最终c(HCO
 )=0.1 mol·L-1,则此时溶液中c(Mn2+)=
)=0.1 mol·L-1,则此时溶液中c(Mn2+)=(6)在“共熔”过程中,需要向煅烧后产生的MnO2固体中添加一定比例的NaNO3、NaOH,反应得到Na2MnO4及一种单质气体,则该反应的化学方程式为
您最近一年使用:0次
解题方法
8 . 全球大气 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①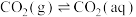

②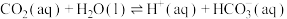

过程①的混合平衡常数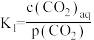 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,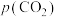 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
_______ (填“增大”或“减小”);当大气压强为akPa,溶液中的 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为_______ 。
(2)由 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。_______ ,有催化剂时决速步骤的活化能为_______ eV。
(3) 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为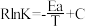 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。
①该反应的活化能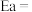
_______ kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图_______ 。 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
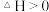 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性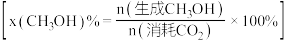 随温度变化关系如下图所示:
随温度变化关系如下图所示:_______ 。
②在压强为P的恒温恒压密闭容器中,加入 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
_______ (列出计算式)。
 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知25℃时,大气中的
 溶于水存在以下过程:
溶于水存在以下过程:①
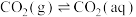

②
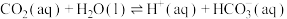

过程①的混合平衡常数
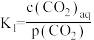 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,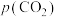 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为(2)由
 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。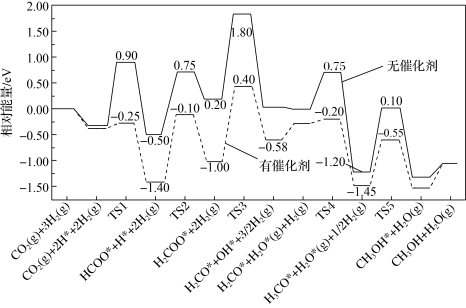
(3)
 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为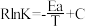 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。①该反应的活化能
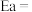
②当使用更高效的催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图
 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
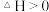 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性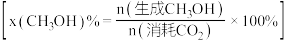 随温度变化关系如下图所示:
随温度变化关系如下图所示: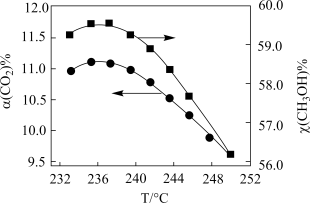
②在压强为P的恒温恒压密闭容器中,加入
 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
您最近一年使用:0次
名校
解题方法
9 . 硒和碲是重要的稀散元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的含量较高,还含有少量 、
、 等元素)分离硒回收碲的工艺流程如下:
等元素)分离硒回收碲的工艺流程如下: 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。
② 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,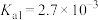 、
、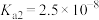
回答下列问题:
(1)硒与氧同族,基态 原子价电子排布式为
原子价电子排布式为___________ 。比较键角大小:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(2)“除杂渣”的主要成分为___________ 。
(3)“中和”时控制 为
为 ,生成
,生成 沉淀,若硫酸过量,将导致
沉淀,若硫酸过量,将导致 的回收率下降的原因是
的回收率下降的原因是___________ 。
(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的 为2,此时溶液中
为2,此时溶液中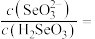
___________ 。
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式___________ 。
(6)一种以 和
和 为电极、
为电极、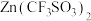 水溶液为电解质的电池,放电时,
水溶液为电解质的电池,放电时, 插入
插入 层间形成
层间形成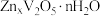 。写出该电池放电时正极的电极反应式
。写出该电池放电时正极的电极反应式___________ 。
 、
、 等元素)分离硒回收碲的工艺流程如下:
等元素)分离硒回收碲的工艺流程如下:
 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。②
 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。③亚硒酸为二元弱酸,
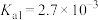 、
、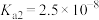
回答下列问题:
(1)硒与氧同族,基态
 原子价电子排布式为
原子价电子排布式为
 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(2)“除杂渣”的主要成分为
(3)“中和”时控制
 为
为 ,生成
,生成 沉淀,若硫酸过量,将导致
沉淀,若硫酸过量,将导致 的回收率下降的原因是
的回收率下降的原因是(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的
 为2,此时溶液中
为2,此时溶液中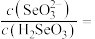
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式
(6)一种以
 和
和 为电极、
为电极、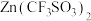 水溶液为电解质的电池,放电时,
水溶液为电解质的电池,放电时, 插入
插入 层间形成
层间形成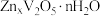 。写出该电池放电时正极的电极反应式
。写出该电池放电时正极的电极反应式
您最近一年使用:0次
2024-05-04更新
|
146次组卷
|
2卷引用:江西省新余市2024届高三下学期第二次模拟考试化学试题
10 . 已知25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为物质
(1)碳酸一级电离的平衡常数表达式为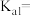
_______ 。
(2)下列四种离子结合 能力最强的是_______。
能力最强的是_______。
(3)酸性强弱:醋酸_______ 次氯酸(填“>”或“<”,下同);经测定,常温下0.1 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,_______ (填“能”或“不能”)说明两者的酸性强弱关系。
(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
(5) 和
和 的混合溶液中,
的混合溶液中,
_______ (用微粒符号表示)。
(6)25℃时,pH=1的硫酸与0.02
 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为_______ 。
| 物质 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 |  |  | 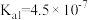 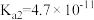 | 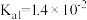 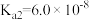 |
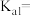
(2)下列四种离子结合
 能力最强的是_______。
能力最强的是_______。A. | B. | C. | D. |
 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
A. | B. | C.醋酸的电离平衡常数 | D.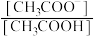 |
 和
和 的混合溶液中,
的混合溶液中,
(6)25℃时,pH=1的硫酸与0.02

 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为
您最近一年使用:0次



